Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
натрия сульфат
Синонимы и иностранные названия:
sodium sulfate (англ.)
sodium sulphate (англ.)
натрий сернокислый (рус.)
тенардит (рус.)
Название вещества с нормальным (не справочным) порядком слов русского языка:
сульфат натрия Тип вещества:
неорганическое
Внешний вид:
бесцветн. ромбические кристаллыКристаллические модификации, структура молекулы, цвет растворов и паров:
Температуры перехода: из ромбической альфа в ромбическую бета-форму 185 С, из бета в гексагональную гамма-форму 241 С.
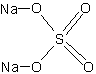
Брутто-формула (по системе Хилла для органических веществ):
Na2O4SФормула в виде текста:
Na2SO4Молекулярная масса (в а.е.м.): 142,04
CAS №: 7757-82-6
Температура плавления (в °C):
884Растворимость (в г/100 г растворителя или характеристика):
1-бутанол: не растворим [Лит.]
аммиак жидкий: не растворим [Лит.]
ацетон: не растворим [Лит.]
бензонитрил: не растворим [Лит.]
вода: 4,5 (0°C) [Лит.]
вода: 9,6 (10°C) [Лит.]
вода: 19,2 (20°C) [Лит.]
вода: 27,9 (25°C) [Лит.]
вода: 40,8 (30°C) [Лит.]
вода: 49,8 (32°C) [Лит.]
вода: 49,8 (38°C) [Лит.]
вода: 48,4 (40°C) [Лит.]
вода: 45,3 (60°C) [Лит.]
вода: 43,3 (80°C) [Лит.]
вода: 42,3 (100°C) [Лит.]
вода тяжелая: 42,9 (40°C) [Лит.]
вода тяжелая: 37,4 (100°C) [Лит.]
гидразин: не растворим [Лит.]
глицерин: растворим [Лит.]
диоксид серы: не растворим [Лит.]
изобутанол: не растворим [Лит.]
изопропанол: 0,00209 (20°C) [Лит.]
изопропанол: 0,00222 (30°C) [Лит.]
изопропанол: 0,00219 (40°C) [Лит.]
изопропанол: 0,00175 (50°C) [Лит.]
метанол: 0,01 (10°C) [Лит.]
метанол: 0,017 (20°C) [Лит.]
метанол: 0,018 (30°C) [Лит.]
метанол: 0,02 (40°C) [Лит.]
метанол: 0,019 (50°C) [Лит.]
метанол 50% водный: 0,46 (10°C) [Лит.]
метанол 50% водный: 0,94 (20°C) [Лит.]
метанол 50% водный: 1,02 (30°C) [Лит.]
метанол 50% водный: 2,35 (40°C) [Лит.]
метанол 50% водный: 2,26 (50°C) [Лит.]
метилацетат: не растворим [Лит.]
муравьиная кислота 95%: 16,5 (19°C) [Лит.]
перекись водорода: 26,7 (0°C) [Лит.]
пропанол: не растворим [Лит.]
серная кислота: 16,3 (20°C) [Лит.]
уксусная кислота: мало растворим [Лит.]
фтороводород: растворим [Лит.]
этанол: 0,44 (20°C) [Лит.]
этанол: 0,48 (40°C) [Лит.]
этилацетат: не растворим [Лит.]
Фазовая и многокомпонентная растворимость (в масс%):
(слой 1): вода 68,06%, натрия сульфат 3,55%, пропан-2-он 28,39%, (слой 2): вода 73,98%, натрия сульфат 2079%, пропан-2-он 5,23%, 30 °C [Лит.]
(слой 1): вода 52,91%, натрия сульфат 0,5%, пропан-2-он 46,59%, (слой 2): вода 69,16%, натрия сульфат 28,17%, пропан-2-он 2,67%, 35 °C [Лит.]
(слой 1): вода 52,12%, натрия сульфат 0,61%, пропан-2-он 47,27%, (слой 2): вода 69,01%, натрия сульфат 28,13%, пропан-2-он 2,87%, 40 °C [Лит.]
(слой 1): вода 51,14%, натрия сульфат 0,91%, пропан-2-он 47,96%, (слой 2): вода 69,84%, натрия сульфат 26,48%, пропан-2-он 3,67%, 50 °C [Лит.]
Плотность:
2,7 (20°C, г/см3, состояние вещества - кристаллы)
Нормативные документы, связанные с веществом:
- ГОСТ № 31940-2012 "Вода питьевая. Методы определения содержания сульфатов." (Описание документа: Определение сульфатов методами обратного титрования с трилоном Б, титрования с хлоридом бария или тубидиметрии.)
- ГОСТ № 4166-76 "Реактивы. Натрий сернокислый. Технические условия." (Описание документа: Сульфат натрия категорий хч, чда, ч.)
Реакции вещества:
- Фтор реагирует с сульфатом натрия с образованием фторида натрия, диоксида-дифторида серы(VI) и кислорода. Реакция начинается при 100 С и быстро протекает при 300 С. [Лит.1]
Na2SO4 + 2F2 → 2NaF + SO2F2 + O2
- Дихлорид дисеры реагирует при нагревании с сульфатом натрия с образованием сульфурилхлорида. [Лит.1]
Na2SO4 + 3S2Cl2 → 2SO2Cl2 + 2NaCl + 5S
Свойства растворов:
10% (вес.), растворитель - вода
Динамическая вязкость (мПа·с) = 1,39 (20°)
Плотность (г/см3) = 1,0905 (20°)
Показатель преломления для D-линии натрия = 1,3479 (20°)
0,017% (вес.), растворитель - метанол
Плотность (г/см3) = 0,81 (20°)
Поверхностное натяжение (в мН/м):
195 (900°C)
190 (950°C)
188 (1000°C)
185 (1080°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-1384,6 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-1266,8 (т)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
149,5 (т)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
127,3 (т)Энтальпия плавления ΔHпл (кДж/моль):
24,3Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-1070 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
345 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
105 (г)Неверная или противоречивая информация:
- Значение растворимости сульфата натрия в жидком аммиаке равное 0,088 г/100 г при 25 С ошибочное. [Лит.]
Дополнительная информация:
При электролизе водного раствора сульфата натрия у катода (отрицательного электрода) происходит выделение водорода за счет протонов воды, а у анода (положительного электрода) - выделение кислорода (из воды); в результате катодное пространство обогащается ионами Na+ и OH- (щелочная среда), а анодное - ионами SO42- и H+ (кислая среда). Сам сульфат натрия в водном растворе электролизу не подвергается.
Источники информации:
- CRC Handbook of Chemistry and Physics. - 95ed. - CRC Press, 2014. - С. 4-91
- Comey A. M., Hahn D. A. A dictionary of Chemical Solubilities Inorganic. - 2 ed. - New York, The MacMillan Company, 1921. - С. 1016-1024
- Seidell A. Solubilities of inorganic and metal organic compounds. - 3ed., vol.1. - New York: D. Van Nostrand Company, 1940. - С. 1300-1315
- Ефимов А.И. и др. Свойства неорганических соединений. Справочник. - Л.: Химия, 1983. - С. 166-167
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 204
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 85
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 670
- Справочник химика. - 2 изд., Т. 2. - Л.-М.: Химия, 1964. - С. 142-143
- Справочник экспериментальных данных по растворимости солевых систем. - Т. 3. - Л.: ГНТИХЛ, 1961. - С. 1606-1644
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер