Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
циклогексанон
Синонимы и иностранные названия:
cyclohexanone (англ.)
анон (рус.)
пимелинкетон (рус.)
секстон (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
C6H10OФормула в виде текста:
CH2(CH2CH2)2COМолекулярная масса (в а.е.м.): 98,143
Температура плавления (в °C):
-40,2Температура кипения (в °C):
155,6Температурные константы смесей (содержание в весовых процентах):
96,3 °C (температура кипения азеотропа, давление 1 атм) вода 55% циклогексанон 45%
Растворимость (в г/100 г растворителя или характеристика):
ацетон: растворим [Лит.]
бензол: растворим [Лит.]
вода: 7 (20°C) [Лит.]
диэтиловый эфир: растворим [Лит.]
сульфолан: смешивается [Лит.]
хлороформ: растворим [Лит.]
этанол: растворим [Лит.]
Плотность:
0,9478 (20°C, г/см3, состояние вещества - жидкость)
Нормативные документы, связанные с веществом:
- МУК № 4.1.618-96 "Методические указания по хромато-масс-спектрометрическому определению летучих органических веществ в атмосферном воздухе"
Метод получения 1:
Источник информации: Гитис С.С., Глаз А.И., Иванов А.В. Практикум по органической химии: Органический синтез. - М.: Высшая школа, 1991 стр. 216-217В трехгорлую круглодонную колбу, снабженную мешалкой, капельной воронкой и термометром, помещают 15 г циклогексанола и 20 мл диэтилового эфира. Содержимое колбы охлаждают до 0...5°С. Отдельно в стакане готовят хромовую смесь, растворяя 13,8 г дихромата натрия в 150 мл воды и смешивая полученный раствор с 12 мл концентрированной серной кислоты (осторожно прибавляют кислоту в водный раствор дихромата). Полученную хромовую смесь из капельной воронки небольшими порциями прибавляют в колбу при работающей мешалке, поддерживая температуру не выше 5 С. После прибавления окислителя продолжают перемешивание реакционной массы в течение 3 ч при комнатной температуре. Затем смесь переносят в делительную воронку и экстрагируют эфиром два раза порциями по 30 мл. Объединенные эфирные вытяжки встряхивают с безводным карбонатом калия, отделяют его и сушат сульфатом натрия.
Далее экстракт помещают в колбу Вюрца, отгоняют сначала на водяной бане эфир, а оставшийся циклогексанон перегоняют на газовой горелке с сеткой, собирая фракцию с т. кип. 155... 157°С.
Выход 12 г (80% от теоретического).
Циклогексанон — бесцветная жидкость. Ограниченно растворим в воде, растворим в спирте, эфире. Т. кип. 156,7°С; 47°С (при 2 кПа или 15 мм рт. ст.); d =0,9478; n = 1,4507.
УФ-Спектр (в гексане): 285 нм (lg e 1,15).
Хроматография: на оксиде алюминия, система циклогексан — диэтиловый эфир (4:1). Rf = 0,24.
Способы получения:
- Пиролиз ториевой соли гептандиовой кислоты. (выход 70-80%) [Лит.]
- Нагреванием циклогексанола с нонагидратом нитрата железа(III) и моногидратом гидросульфата натрия без растворителя при 90 С 185 минут. (выход 90%) [Лит.]
- Окисление циклогексанола дихроматом натрия в серной кислоте. (выход 65%) [Лит.]
- Реакцией циклогексанола с оксалилдихлоридом и диметилсульфоксидом. (выход 90%) [Лит.]
- Изомеризация эпоксида циклогексена при нагревании с октакарбонилом дикобальта. (выход 73%) [Лит.]
- Пиролиз кальциевой или железной(II) соли гептандиовой кислоты. (выход 32-56%) [Лит.]
Реакции вещества:
- Окисляется оксидом селена(IV) до циклогексан-1,2-диона. (выход 25%) [Лит.]
- Реагирует с этиловым эфиром циануксусной кислоты и серой с образованием этилового эфира 2-амино-4,5-тетраметилентиофен-3-карбоновой кислоты. (выход 80%) [Лит.]
- Конденсируется с формальдегидом и гидрохлоридом диметиламина с образованием 2-(диметиламинометил)циклогексанона. (выход 85%) [Лит.]
- Конденсируется с формальдегидом и гидрохлоридом метиламина с образованием N-метил-N,N-бис(циклогексан-2-он-1-илметил)амина. (выход 2,4%) [Лит.]
- Конденсируется с формальдегидом и гидрохлоридом бензиламина с образованием 2-(бензиламинометил)циклогексанона с примесью производного декагидроизохинолина. (выход 65%) [Лит.]
- Конденсируется с формальдегидом и хлоридом аммония с образованием трис(циклогексан-2-он-1-илметил)амина. [Лит.]
- Конденсируется с формальдегидом и гидрохлоридом 3,4-метилендиоксибензиламина с образованием 2-[N-(3,4-метилендиоксибензил)аминометил]циклогексанона. [Лит.]
- Реагирует с ацетиленидом натрия в жидком аммиаке с образованием, после подкисления и экстракции эфиром, 1-этинилциклогексанола. (выход 65%) [Лит.]
- Реагирует с амидом натрия давая натриевую соль по α-положению, которая может реагировать с аллилбромидом с образованием 2-аллилциклогексанона. (выход 54%) [Лит.]
- Реагирует с циануксусной кислотой в присутствии ацетата аммония с образованием 2-(циклогексилиден)-2-циануксусной кислоты. (выход 65%) [Лит.]
- Реагирует с морфолином в толуоле в присутствии п-толуолсульфокислоты с образованием циклогек-1-ен-1-илморфолина. (выход 72%) [Лит.]
- Реагирует с комплексом уксусной кислоты и трифторида бора (1/1) с образованием 2-ацетилциклогексанона. (выход 86%) [Лит.]
- Окисляется раствором гипобромита натрия до адипиновой кислоты. (выход 82%) [Лит.]
- Реагирует с 2-хлорпропаннитрилом в присутствии трет-бутилата калия с образованием 2-метил-3,3-(пентан-1,5-диил)оксиран-2-карбонитрила. (выход 79%) [Лит.]
- Реагирует с азотистоводородной кислотой в присутствии серной кислоты с образованием ε-капролактама. (выход 70%) [Лит.]
- Реагирует с этиловым эфиром хлоруксусной кислоты в присутствии трет-бутилата калия с образованием этилового эфира 3,3-(пентан-1,5-диил)оксиран-2-карбоновой кислоты. (выход 83%) [Лит.]
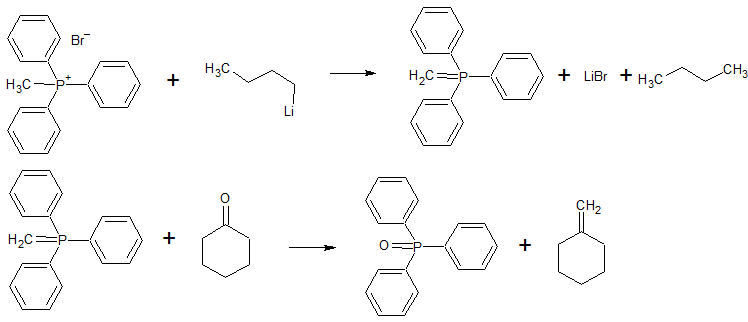
- Метиленциклогексан можно получить реакцией метилтрифенилфосфонийбромида с бутиллитием и циклогексаноном. Выход 35-40%. Название реакции: реакция Виттига. [Лит.1]
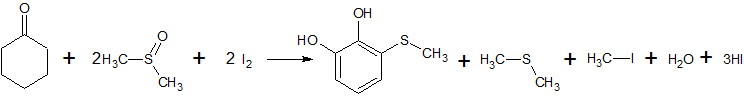
- При реакции циклогексанона с иодом и диметилсульфоксидом при 80 С в течение 24 часов в запаяной трубке образуется 1,2-дигидрокси-3-метилтиобензол. Выход 84%. [Лит.1
 ]
]
- Циклогексанон реагирует с диметиламином в диэтиловом эфире в присутствии хлорида кальция в течение 64 часов при комнатной температуре с образованием 1-(диметиламино)циклогексена. Выход 83% (на прореагировавший циклогексанон, превращение 52%). [Лит.1]
- Адипиновая кислота может быть получена окислением циклогексанона водным раствором перманганата калия при 50 С. В процессе реакции также выделяется кислород. Выход 58%. [Лит.1
 ]
] - В присутствии следов диметилформамида или пиридина циклогексанон реагирует с карбонилфторидом с образованием 1-фторциклогексилфторформиата. Выход 64%. [Лит.1]
Показатель преломления (для D-линии натрия):
1,4507 (20°C)
Давление паров (в мм рт.ст.):
4,4 (20°C)
15 (47°C)
Показатели диссоциации:
pKBH+ (1) = -6,8 (25°C, вода)
Диэлектрическая проницаемость:
18,3 (20°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
2,2 (25°C)
Удельная теплоемкость при постоянном давлении (в Дж/г·K):
1,8 (20°C)
Температура вспышки в воздухе (°C):
40Температура самовоспламенения на воздухе (°C):
495Летальная доза (ЛД50, в мг/кг):
2780 (белые мыши, перорально)
1540 (кролики, внутрибрюшинно)
1130 (крысы, внутрибрюшинно)
930 (морские свинки, внутрибрюшинно)
1400 (мыши, перорально)
1230 (мыши, внутрибрюшинно)
Разные дозы:
ЛД100 (мыши, перорально) = 1800 мг/кг.
Симптомы острого отравления:
Токсическое действие на животных. Наркотик. При остром отравлении у белых мышей, морских свинок и кошек 15 мг/л вызвали раздражение слизистых оболочек, нарушение равновесия, сонливость; у многих животных через час наркоз (Тrеоn et al.). Концентрации 15, 20 и 25 мг/л вызвали наркоз длительностью от 8 до 56 ч, 5 и 10 мг/л - возбуждение и атаксию (Воронин). Минимальная наркотическая концентрация при 2-часовом воздействии для мышей и крыс 2,5-3 мг/л. При 2-часовом вдыхании для мышей ЛК50 = 23,75-25 мг/л (Тrеоn et al.; Воронин) и 9,7 мг/л (Ломонова). Пороговая концентрация для мышей по изменению суммационной способности нервной системы при 40-минутной экспозиции 1,2 мг/л; для крыс по влиянию на условнорефлекторную деятельность при 2-часовой экспозиции 0,1 мг/л (Ломонова). Минимальная концентрация, изменяющая протекание безусловного рефлекса кроликов, при 40-минутном воздействии 8 мг/л, при 8-часовой экспозиции 0,4-0,65 мг/л, нарушающая условно-рефлекторную деятельность (экспозиция 40 мин) 2-8 мг/л, изменяющая частоту дыхания 0,5-2,0 мг/л. У кошек 10-25 мг/л при 0,5-часовом воздействии вызвали слюнотечение (Воронин).
Наркоз - без стадии возбуждения (Новгородова и др.). Концентрация 12 мг/л при общей длительности экспозиции 90 ч (15 раз по 6 ч) вызвала гибель 50% подопытных кроликов при картине легкого наркоза, затрудненного дыхания, конъюнктивита (Тrеоn et al.).
Действие на человека. Минимальная концентрация, вызывающая раздражение глаз и верхних дыхательных путей при минутной экспозиции, 0,5 мг/л (Воронин). Порог восприятия запаха у наиболее чувствительных лиц 0,00021 мг/л, порог изменения световой чувствительности - на уровне 0,00011 мг/л; порог рефлекторного действия на электрическую активность головного мозга 0,00006 мг/л (Добринский). Концентрация 0,1 мг/л оценивалась как переносимая в течение 8 ч, 0,3 мг/л вызвали раздражение слизистых оболочек глаз, носа и горла (Nelson et al.).
Поступление в организм и выделение. Жидкий циклогексанон всасывается через кожу. До 50% циклогексанона выделяется с мочой в связанном с серной и глюкуроновой кислотами виде (Elliot et al.; Тrеоn et. al.).
Симптомы хронического отравления:
Хроническое отравление у животных. У мышей, крыс и кроликов, вдыхавших 2 мг/л в течение 80-110 дней по 6-6,5 ч в день, наблюдалось отставание роста, снижение потребления кислорода, временный лейкоцитоз, эозинофилия, сдвиг лейкоцитарной формулы влево, увеличение протромбинового времени, повышение возбудимости центральной нервной системы, изменение массы щитовидной железы, надпочечников и внутренних органов. Воздействие 0,1 мг/л в течение 4 месяцев вызвало у крыс лишь изменение условнорефлекторной деятельности (Воронин; Ломонова). При круглосуточном вдыхании 0,46 мг/м3 в течение 87 дней у крыс отмечены нарушение соотношения хронаксии мышц-антагонистов, повышение активности холинэстеразы крови, уменьшение количества SH-групп в сыворотке крови (Добринский).
Применение:
Растворитель для резин, каучуков, смол, клеев. В производстве адипиновой кислоты и капролактама.
Источники информации:
- Dictionary of organic compounds. - vol.1, Abietic acid - Dypnone. - London, 1946. - С. 597
- Yalkowsky S.H., Yan H. Handbook of aqueous solubility data. - CRC Press, 2003. - С. 285
- Альберт А., Сержент Е. Константы ионизации кислот и оснований. - М.-Л.: Химия, 1964. - С. 138
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.1. - Л.: Химия, 1976. - С. 541-543
- РЖ Токсикология, Отдельный выпуск. - 1980. - №1. - С. 21
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 195
- Свойства органических соединений: Справочник. - Под ред. Потехина А.А. - Л.: Химия, 1984. - С. 420-421
- Справочник химика. - 2 изд., Т. 2. - Л.-М.: Химия, 1964. - С. 1100-1101
- Химическая энциклопедия. - Т. 5. - М.: Советская энциклопедия, 1999. - С. 366
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 680-681
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер



