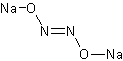
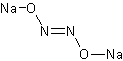
Гипонитрит-ион имеет транс-конфигурацию.
Раствор этилата натрия полученный реакцией 6,62 г натрия с абсолютным спиртом прилили к раствору 20 г хлорида гидроксиламмония в абсолютном спирте. Смесь охладили и отфильтровали выпавший осадок хлорида натрия. Затем в смесь добавили еще раствор этилата натрия, приготовленный из 15,4 г натрия. Полученную смесь охладили охлаждающей смесью и в смесь перегнали расчетное количество этилнитрита. Происходит осаждение гипонитрита натрия. Несколько минут спустя, когда весть этилнитрит был добавлен, соль отфильтровывают, промывают холодным абсолютным спиртом и затем эфиром. Выход 4,1 г (13,5%). Если продукт реакции отфильтровать не сразу, может произойти загрязнение гипонитрита выделяющимся нитритом натрия.
Для реакции необходим избыток этилата натрия, иначе снижается выход гипонитрита. Если этилнитрит не отгонять в раствор гидроксиламина, а добавлять частями - выход снижается.
500 мл трехгорлую колбу снабдили магнитной мешалкой и подключением газовой линии через Т-образный переключатель линий азота и оксида азота(II). В колбу поместили 100 мл 1,2-диметоксиэтана и 150 мл толуола (оба перегнаны из синих растворов натрия с бензофеноном). В раствор поместили 26 г бензофенона и включили поток азота. Добавили 6,9 г натрия в виде проволоки и колбу поместили на ледяную баню. После продувки азотом переключили на подачу оксида азота(II) под небольшим давлением при перемешивании. Встряхивание колбы увеличивало поглощение газа. Реакция почти заканчивается через 20 минут. После этого перемешивают еще 1 час в атмосфере оксида азота(II) и продувают азотом. К перемешиваемой смеси по каплям (вспенивание) добавляют 10 мл воды и раствор экстрагируют тремя порциями по 70 мл воды. К объединенному экстракту добавляют 200 мл абсолютного этанола, смесь перемешивают, охлаждают и если необходимо индуцируют кристаллизацию. Выпавшую натриевую соль отфильтровывают и промывают абсолютным этанолом и эфиром. После высушивания на воздухе получают 3,5 г кремового порошка гипонитрита натрия, но содержащего воду и этанол.
Выход (рассчитанный по осадку гипонитрита серебра) 8 % на натрий.
85 г NaNO3 растворяют в 250 мл воды, охлаждают раствор льдом и при помешивании или встряхивании приливают амальгаму натрия. Амальгама изготовляется растворением 58 г натрия в 4000 г ртути. После добавления 75% всей амальгамы охлаждение прекращают и остаток амальгамы приливают сразу. Встряхивание продолжают еще 10—15 мин, причем температура смеси повышается до 40°. Когда температура начнет понижаться, жидкость сливают в узкогорлую склянку с притертой пробкой, споласкивают остаток 2—3 мл воды и сильно встряхивают в течение примерно 10 мин. Затем, прибавляя к капле раствора небольшие количества воды и AgNO3, делают пробу на полноту удаления из раствора образовавшегося гидроксиламина. Раствор сливают со ртути и помещают в вакуум-эксикатор над серной кислотой при 35—40° для удаления всего NH3. При этом выделяется Na2N2O2, который отсасывают на нуче с пористой стеклянной пластинкой и промывают спиртом при температуре выше 10°, чтобы удалить из него примесь NaOH. Осадок высушивают в эксикаторе.
К суспензии гипонитрита серебра Ag2N2O2 добавляют столько раствора NaCl, чтобы еще оставалась едва заметная слабая желтая окраска. Осадок отфильтровывают, в течение короткого времени промывают и концентрируют в вакууме до кристаллизации, после чего высушивают в эксикаторе.
Свойства. Небольшие зернистые кристаллы. В вакууме они выделяют кристаллизационную воду. В безводном состоянии соль похожа на белую магнезию; легко растворима в воде.