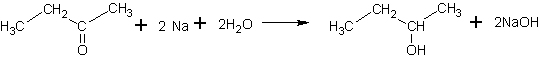Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
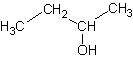
(RS)-бутан-2-ол
Синонимы и иностранные названия:
2-butanol (англ.)
2-hydroxy-butane (англ.)
2-бутанол (рус.)
s-butanol (англ.)
бутанол-2 (рус.)
втор-бутиловый спирт (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
C4H10OФормула в виде текста:
CH3CH2CH(CH3)OHМолекулярная масса (в а.е.м.): 74,12199
CAS №: 78-92-2
Температура плавления (в °C):
-114,7Температура кипения (в °C):
99,5Растворимость (в г/100 г растворителя или характеристика):
ацетон: хорошо растворим [Лит.]
бензол: растворим [Лит.]
вода: 11,11 (20°C) [Лит.]
вода: 13,04 (85°C) [Лит.]
вода: 13,42 (90,04°C) [Лит.]
диэтиловый эфир: смешивается [Лит.]
этанол: смешивается [Лит.]
Плотность:
0,8063 (20°C, г/см3, состояние вещества - жидкость)
Метод получения 1:
Источник информации: Агрономов А.Е., Шабаров Ю.С. Лабораторные работы в органическом практикуме. - М., 1974 стр. 127
В колбу с двурогим форштоссом емкостью 100 мл, снабженную обратным холодильником, помещают 8,5 г метилэтилкетона, 15 мл эфира и 16 мл воды. При охлаждении реакционной колбы ледяной водой и непрерывном встряхивании постепенно добавляют в нее маленькими кусочками 8 г металлического натрия. Когда прибавлена половина всего количества натрия, в колбу доливают еще 8 мл воды. В конце реакции натрий можно вводить большими порциями. Когда весь натрий прореагировал, верхний слой отделяют, а нижний (водный) один раз экстрагируют 40 мл эфира. Эфирную вытяжку объединяют с органическим слоем, один раз промывают водой, сушат над MgSO4 и перегоняют, собирая фракцию с т. кип. 95-101°С.
Выход составляет 6 г (70% от теоретического).
В колбе после перегонки остается небольшое количество пинакона метилэтилкетона. При повторной перегонке бутанол-2 собирают в интервале 98-100°С; n=1,3955.
Способы получения:
- Реакция промышленной смеси 1-бутена и 2-бутена с концентрированной серной кислотой, с последующим гидролизом. (выход 80%) [Лит.]
- 2-Бутанон восстанавливается алюмогидридом лития (0,25 моль/моль) до 2-бутанола. Выход 80%. [Лит.1]
Диэлектрическая проницаемость:
15,8 (20°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-342,6 (ж)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
214,9 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
196,9 (ж)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-292,8 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
359,5 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
112,7 (г)Летальная доза (ЛД50, в мг/кг):
4893 (кролики, перорально)
6480 (крысы, перорально)
138 (крысы, внутривенно)
1193 (крысы, внутрибрюшинно)
764 (мыши, внутривенно)
Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 5-27
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 268-270
- Smallwood I.M. Handbook of organic solvent properties. - 1996. - С. 85-87
- Yalkowsky S.H., Yan H., Jain P. Handbook of aqueous solubility data. – 2nd ed. - CRC Press, 2010. - С. 132
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 134
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 407-408
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер