Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
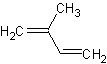
2-метилбута-1,3-диен
Синонимы и иностранные названия:
2-methyl-1,3-butadiene (англ.)
2-метил-1,3-бутадиен (рус.)
2-метилбутадиен-1,3 (рус.)
isoprene (англ.)
изопрен (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
C5H8Формула в виде текста:
CH2=C(CH3)CH=CH2Молекулярная масса (в а.е.м.): 68,117
Температура плавления (в °C):
-145,95Температура кипения (в °C):
34,067Температурные константы смесей (содержание в весовых процентах):
22,5 °C (температура кипения азеотропа, давление 1 атм) 2-метилбута-1,3-диен 50% муравьиной кислоты метиловый эфир 50%
Растворимость (в г/100 г растворителя или характеристика):
вода: 0,06419999999 (25°C) [Лит.]
диэтиловый эфир: хорошо растворим [Лит.]
этанол: хорошо растворим [Лит.]
Плотность:
0,6849 (16°C, относительно воды при 4°C, состояние вещества - жидкость)
0,6809 (20°C, относительно воды при 4°C, состояние вещества - жидкость)
Способы получения:
- Термическое разложение натурального каучука в вакууме при 500-900 С. (выход 40%) [Лит.]
- 3-Метил-1-фенил-3-фосфолен реагирует с диэтилпероксидом с образованием изопрена и диэтилового эфира фенилфосфонистой кислоты с промежуточным образованием фосфорана. [Лит.1]
Реакции вещества:
- Присоединяет бром в растворе тетрахлорметана. [Лит.]
- При -20 С присоединяет хлороводород с образованием 3-метил-3-хлор-1-бутена. [Лит.]
- При -20 С присоединяет бромоводород с образованием 3-бром-3-метил-1-бутена. [Лит.]
- Реагирует с раствором хлора в тетрахлорметане с образованием смеси 2-метил-1-хлор-1,3-бутадиена и 2-метил-1,4-дихлор-2-бутена. [Лит.]
- Присоединяет хлорноватистую кислоту. [Лит.]
- Спиртовый или эфирный раствор изопрена реагирует с жидким сернистым ангидридом. [Лит.]
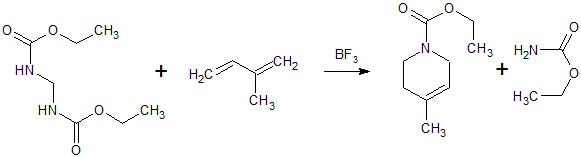
- Метилендиуретан с трифторидом бора и изопреном при 70-90 С в течение 10 часов образует этиловый эфир 4-метил-1,2,5,6-тетрагидропиридин-1-карбоновой кислоты. [Лит.1]
Показатель преломления (для D-линии натрия):
1,4219 (20°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
48,2 (ж)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
229,3 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
152,6 (ж)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
75,5 (г)Энтальпия плавления ΔHпл (кДж/моль)
4,83 (т) [Лит.]
Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 5-28
- Yalkowsky S.H., Yan H., Jain P. Handbook of aqueous solubility data. – 2nd ed. - CRC Press, 2010. - С. 149
- Вацулик П. Химия мономеров. - Т.1. - М.: ИИЛ, 1960. - С. 547-561 (способы синтеза)
- Мономеры. - Вып.1. - М.: ИИЛ, 1951. - С. 110-130
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 150
- Справочник химика. - 2 изд., Т. 2. - Л.-М.: Химия, 1964. - С. 688-689
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер