Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
1-фенилэтанон
Синонимы и иностранные названия:
1-phenylethanone (англ.)
acetophenone (англ.)
ацетилбензол (рус.)
ацетофенон (рус.)
метилфенилкетон (рус.)
Тип вещества:
органическое
Внешний вид:
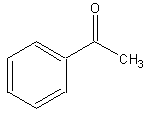
бесцветн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
C8H8OФормула в виде текста:
C6H5C(O)CH3Молекулярная масса (в а.е.м.): 120,15
Температура плавления (в °C):
19,62Температура кипения (в °C):
202,3Температуры плавления под давлением (в °C):
41,2 (100 МПа)
Растворимость (в г/100 г растворителя или характеристика):
1-бутиламин: смешивается [Лит.]
аммиак жидкий: растворим (-33°C) [Лит.]
ацетон: растворим [Лит.]
бензол: растворим [Лит.]
вода: 0,5371 (25°C) [Лит.]
вода: 0,7937 (60°C) [Лит.]
глицерин: растворим [Лит.]
диэтиламин: смешивается [Лит.]
диэтиловый эфир: растворим [Лит.]
трибутиламин: смешивается [Лит.]
фтороводород: легко растворим [Лит.]
хлороформ: растворим [Лит.]
этанол: 106,6 (0,2°C) [Лит.]
этанол: 852,4 (11°C) [Лит.]
этанол: смешивается (25°C) [Лит.]
Плотность:
1,0281 (20°C, г/см3, состояние вещества - жидкость)
1,01947 (30°C, г/см3, состояние вещества - жидкость)
1,015 (35°C, г/см3, состояние вещества - жидкость)
1,0106 (40°C, г/см3, состояние вещества - жидкость)
1,0063 (45°C, г/см3, состояние вещества - жидкость)
1,0021 (50°C, г/см3, состояние вещества - жидкость)
0,9978 (55°C, г/см3, состояние вещества - жидкость)
Вкус, запах, гигроскопичность:
запах: черемухи
Нормативные документы, связанные с веществом:
- МУК № 4.1.618-96 "Методические указания по хромато-масс-спектрометрическому определению летучих органических веществ в атмосферном воздухе"
Метод получения 1:
Источник информации: Голодников Г.В. Практические работы по органическому синтезу. - Л.: ИЛУ, 1966 стр. 160-161C6H6 + (CH3CO)2O → C6H5COCH3 + CH3COOH
Работу проводить в вытяжном шкафу!
Реакцию проводят в круглодонной колбе емкостью 250 мл с тремя тубусами. К среднему широкому тубусу присоединяют механическую мешалку, к одному из боковых тубусов—обратный холодильник, к другому — капельную воронку. В колбу помещают 40 г высушенного над металлическим натрием бензола и затем 32 г свежевозогнанного хлористого алюминия. После этого при энергичном перемешивании прибавляют (через капельную воронку) в течение получаса 10,2 г чистого уксусного ангидрида. Смесь разогревается, происходит бурное выделение хлористого водорода. Продолжая перемешивание, реакционную смесь нагревают до кипения еще в течение получаса (на водяной бане).
Охлажденный раствор выливают на лед (находящийся в делительной воронке) и, прибавляя концентрированную соляную кислоту, растворяют выделившийся Аl(ОН)3. Добавив небольшое количество эфира, отделяют бензольно-эфирный слой, а водный слой извлекают еще раз эфиром. Соединенные вытяжки встряхивают с раствором едкого натра и сушат хлористым кальцием. Отогнав растворитель, перегоняют ацетофенон (лучше всего в вакууме).
Выход — 10 г (80%). Чистый ацетофенон имеет т. пл. 20,5°С; т. кип. 202,3°С; показатель преломления n = 1,8342.
Метод получения 2:
Источник информации: Голодников Г.В. Практические работы по органическому синтезу. - Л.: ИЛУ, 1966 стр. 161
Работу проводить в вытяжном шкафу!
В колбу, соединенную с обратным холодильником и капельной воронкой, вносят 20 г высушенного над металлическим натрием бензола и 25 г свежевозогнанного хлористого алюминия. Колбу ставят в ледяную воду и по каплям прибавляют 18 г хлористого ацетила. Через 10 мин колбу на полчаса помещают в нагретую до 30° С водяную баню, а затем оставляют стоять в течение 1 ч при комнатной температуре, после чего выливают содержимое колбы в 120 мл разбавленной кислоты (содержащей лед). Реакционную смесь переносят в делительную воронку и, добавив еще немного бензола, взбалтывают.
Бензольный раствор отделяют, промывают разбавленным раствором едкого натра и водой и сушат хлористым кальцием. Отогнав бензол, перегоняют ацетофенон в вакууме.
Выход— 10—15 г (37—55%).
Метод получения 3:
Источник информации: Методы элементоорганической химии: Цинк, кадмий. - М.: Наука, 1964 стр. 78К раствору 0,19 моля фениллития в 175 мл эфира осторожно прибавляют 20 г (0,145 моля) хлористого цинка. При этом наблюдают энергичное кипение реакционной смеси. Когда прибавлено все количество хлористого цинка, проба Гилмана становится отрицательной. Затем отгоняют эфир до объема реакционной смеси 150 мл и при охлаждении добавляют 12,5 г (0,16 моля) хлористого ацетила в 100 мл сухого бензола, после чего реакционную смесь нагревают с обратным холодильником в течение 1 часа. Холодную реакционную смесь разлагают льдом и разбавленной соляной кислотой. Органический слой промывают раствором карбоната натрия, водой и сушат. После перегонки получают 15,6 г (81%) ацетофенона.
Метод получения 4:
Источник информации: Соборовский Л.З., Якубович А.Я. Синтезы отравляющих веществ. - М.: ГРХЛ, 1936 стр. 38C6H6 + (CH3CO)2O → C6H5COCH3 + CH3COOH
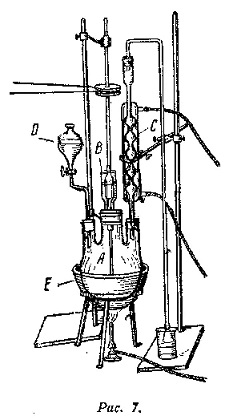 200 г бензола и 224 г безводного хлористого алюминия помещают в круглодонную трёхгорлую колбу A ёмкостью 1 л, снабжённую мешалкой с затвором B, обратным холодильником C и капельной воронкой D. К нагреваемой на водяной бане E смеси при непрерывном перемешивании постепенно прибавляют из капельной воронки 51 г уксусного ангидрида. Реакция сопровождается энергичным выделением хлористого водорода (примеч. 1). Нагревание и перемешивание продолжается около 5 часов при температуре бани 90°.
200 г бензола и 224 г безводного хлористого алюминия помещают в круглодонную трёхгорлую колбу A ёмкостью 1 л, снабжённую мешалкой с затвором B, обратным холодильником C и капельной воронкой D. К нагреваемой на водяной бане E смеси при непрерывном перемешивании постепенно прибавляют из капельной воронки 51 г уксусного ангидрида. Реакция сопровождается энергичным выделением хлористого водорода (примеч. 1). Нагревание и перемешивание продолжается около 5 часов при температуре бани 90°.
По окончании реакции полученную реакционную массу выливают тонкой струёй в хорошо перемешиваемую смесь льда с серной кислотой. Кислота берётся с небольшим избытком против необходимого количества для удаления алюминия в качестве растворимой в воде соли. Масляный слой, состоящий из бензольного раствора ацетофенона, отделяется с помощью делительной воронки, промывается несколько раз взбалтыванием с водой для удаления минеральной кислоты и алюминиевых солей и перегоняется с водяным паром. При этом в дистиллят переходят бензол и ацетофенон, а в перегонной колбе остаётся нелетучий с паром остаток продуктов конденсации. Масляный слой отделяют, сушат хлористым кальцием, отгоняют бензол при обыкновенном давлении и затем ацетофенон перегоняют в вакууме (примеч. 2).
Выход 96 г ацетофенона, т. е. 80% теории.
Примечания.
1. К обратному холодильнику присоединяется трубка для отвода HCl в тягу или для поглощения его над поверхностью воды.
2. Ацетофенон можно перегонять и при обычном давлении; темп. кип. 202°.
Способы получения:
- Окисление этилбензола бихроматом калия в воде при 250°С. (выход 50%) [Лит.]
- Нагреванием 1-фенилэтанола с нонагидратом нитрата железа(III) и моногидратом гидросульфата натрия без растворителя при 90°С 25 минут. (выход 95%) [Лит.]
- Реакцией ацетилхлорида с бензолом в присутствии цинковой пыли при 60°С при облучении микроволновым излучением (300 Вт) в течение 30 секунд. (выход 95%) [Лит.]
- Реакцией 1-фенилэтанола с оксалилдихлоридом и диметилсульфоксидом. (выход 85%) [Лит.]
- Реакцией фениллития с N-метилацетамидом. (выход 28-31%) [Лит.]
Используется для синтеза веществ:
1,3-дифенилпроп-2-ен-1-он
2-бром-1-фенилэтанон
2-фенилэтанамид
фенилуксусная кислота
Реакции вещества:
- Конденсируется с формальдегидом и гидрохлоридом бензиламина с образованием 3-(бензиламино)-1-фенилпропан-1-она. (выход 53%) [Лит.]
- Конденсируется с формальдегидом и гидрохлоридом 3,4-метилендиоксибензиламина с образованием 3-(N-(3,4-метилендиоксибензил)амино)-1-фенилпропан-1-она. (выход 56%) [Лит.]
- Конденсируется с формальдегидом и хлоридом аммония с образованием трис(2-бензоилэтил)амина и 1-(2-бензоилэтил)-3-бензоил-4-гидрокси-4-фенилпиперидина. [Лит.]
- Конденсируется с формальдегидом и гидрохлоридом метиламина с образованием 3-(метиламино)-1-фенилпропан-1-она. [Лит.]
- Самоконденсируется при нагревании в присутствии трет-бутилата алюминия в ксилоле с отгонкой трет-бутанола до 1,3-дифенилбут-2-ен-1-она. (выход 77%) [Лит.]
- Реагирует с иодом и оксидом меди(II) в молярном соотношении 1:1:1, в кипящем метаноле, в течение 1 часа, с образованием 2-иод-1-фенилэтанона. (выход 96%) [Лит.]
- Окисляется пероксиуксусной кислотой до фенилацетата. (выход 33%) [Лит.]
- Окисляется пероксибензойной кислотой до фенилацетата. (выход 63%) [Лит.]
- Реагирует с 25% водным раствором аммиака и иодом в запаяной трубке при 60 С в течение 1 часа с образованием бензамида. (выход 86%) [Лит.]
- Окисляется при нагревании с перокситрифторуксусной кислотой в дихлорметане в присутствии гидрофосфата натрия до фенилацетата. (выход 90%) [Лит.]
- Реагирует без растворителя с иодом и аддуктом мочевины с пероксидом водорода в молярном соотношении 1:1:1 при 45°С в течение 6 часов с образованием 2-иод-1-фенилэтанона. (выход 65%) [Лит.]
- Кипячение в течение 3 часов при 130 С с морфолином, серой и п-толуолсульфокислотой дает морфолид фенилуксусной кислоты. При реакции без толуолсульфкислоты выход 49%. (выход 94%) [Лит.]
- Окисляется оксидом селена(IV) до фенилглиоксаля. (выход 50%) [Лит.]
- Реагирует с бромом без растворителя в присутствии 2,5 экв хлорида алюминия с образованием м-бромацетофенона. (выход 70%) [Лит.]
- Реагирует в эфире с бромом в присутствии каталитических количеств хлорида алюминия с образованием α-бромацетофенона. (выход 64%) [Лит.]
- Реагирует с этилхлорацетатом в присутствии амида натрия в бензоле с образованием этилового эфира 3-метил-3-фенилоксиран-2-карбоновой кислоты. (выход 62%) [Лит.]
- Реагирует в бензоле в присутствии серной кислоты с азотистоводородной кислотой давая ацетанилид. (выход 77%) [Лит.]
- Реагирует с амальгамой алюминия в бензольно-этанольном растворе с образованием смеси изомеров 2,3-дифенилбутан-2,3-диола. (выход 54%) [Лит.]
- При облучении солнечным светом раствора в изопропаноле в присутствии уксусной кислоты в течение нескольких месяцев дает 2,3-дифенилбутан-2,3-диол. (выход 66%) [Лит.]
- Реагирует с диэтилацеталем диметилформамида с образованием 2-диметиламино-1-фенил-1-этанона. [Лит.]
- Реагирует с амальгамированным цинком в соляной кислоте с образованием этилбензола. (выход 80%) [Лит.]
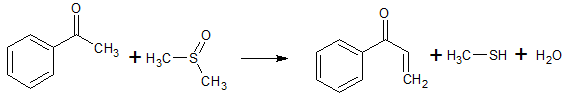
- Ацетофенон реагирует с диметилсульфоксидом и персульфатом калия в присутствии ацетата натрия при 120 С с образованием 1-фенилпроп-2-ен-1-она. Выход 85%. [Лит.1
 ]
]
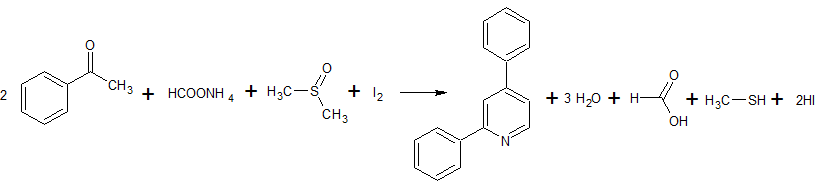
- Ацетофенон реагирует с диметилсульфоксидом и формиатом аммония в присутствии тригидрата нитрата меди(II) и иода при 130 С с образованием 2,4-дифенилпиридина. Выход 74%. [Лит.1
 ]
]
- Бензоилхлорид можно получить нагревая ацетофенон с дихлоридом дисеры в присутствии пиридина. Выход 82% (неочищенного продукта). [Лит.1
 ]
]
C6H5COCH3 + 2S2Cl2 → C6H5COCl + 3HCl + CS2 + 2S
- Бензоилхлорид можно получить нагревая ацетофенон с тионилхлоридом в присутствии пиридина. Выход 83% (по данным ПМР). [Лит.1
 ]
] - Бензоилхлорид можно получить нагревая ацетофенон с дихлоридом дисеры в присутствии пиридина, а затем в присутствии сульфурилхлорида. Выход 87% (неочищенного продукта). [Лит.1
 ]
] - Ацетофенон реагирует с этиловым эфиром 2-бромпропионовой кислоты и цинком в бензоле с образованием (после кислотного гидролиза) этилового эфира 3-гидрокси-2-метил-3-фенилбутановой кислоты. Выход 75-81%. Название реакции: реакция Реформатского. [Лит.1
 ]
]
C6H5COCH3 + CH3CHBrCOOC2H5 + Zn → C6H5C(CH3)(OZnBr)CH(CH3)COOC2H5
C6H5C(CH3)(OZnBr)CH(CH3)COOC2H5 + H2SO4 → C6H5C(CH3)(OH)CH(CH3)COOC2H5 + ZnSO4 + HBr
- Ацетофенон конденсируется с формальдегидом и гидрохлоридом диметиламина с образованием 3-(диметиламино)-1-фенил-1-пропанона. Выход 60%. Название реакции: реакция Манниха. [Лит.1]
C6H5COCH3 + CH2O + HN(CH3)2 * HCl → C6H5COCH2CH2N(CH3)2 + HCl + H2O
- Ацетофенон реагирует с иодом в растворе пиридина с образованием иодида N-фенацилпиридиния. [Лит.1]
C6H5COCH3 + I2 + 2C5H5N → [C6H5COCH2NC5H5]I + C5H5NHI
- Ацетофенон при реакции с избытком красной азотной кислоты (d = 1,4) образует дибензоилфуроксан. Выход 30%. [Лит.1]
Показатель преломления (для D-линии натрия):
1,5372 (20°C)
Давление паров (в мм рт.ст.):
10 (79°C)
Показатели диссоциации:
pKa (1) = 19 (20°C, вода, CH3 группа)
Индекс удерживания для газовой хроматографии:
1041,5 (фаза колонки - полидиметилсилоксан)
1067,4 (фаза колонки - полидиметилсилоксан с 5% фенильных групп)
Диэлектрическая проницаемость:
17,39 (25°C)
8,64 (202°C)
Дипольный момент молекулы (в дебаях):
3,02 (20°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
1,511 (30°C)
1,3992 (35°C)
1,1922 (45°C)
1,132 (48°C)
Энтальпия кипения ΔHкип (кДж/моль):
38,79Теплота сгорания (кДж/моль):
4137,6Летальная доза (ЛД50, в мг/кг):
2650 (белые крысы, перорально)
1250 (мыши, перорально)
Спектральные свойства вещества:
Ультрафиолетовый/видимый спектр (максимум в нм, толщина слоя 1 см, в скобках - экстинция) = 242 (126) (этанол)
Ультрафиолетовый/видимый спектр (максимум в нм, толщина слоя 1 см, в скобках - экстинция) = 279 (105) (этанол)
Ультрафиолетовый/видимый спектр (максимум в нм, толщина слоя 1 см, в скобках - экстинция) = 318 (6) (этанол)
Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 8-87
- Gangolli S. The Dictionary of Substances and their Effects. - 2 ed., Vol. 1, A-B. - RSC, 1999. - С. 38-39
- Lewis R.J. Sax's Dangerous Properties of Industrial Materials. - 11ed. - Wiley-interscience, 2004. - С. 26
- Milne G.W.A. Gardner's Commercially Important Chemicals. - Wiley-Interscience, 2005. - С. 8
- Yalkowsky S.H., Yan H. Handbook of aqueous solubility data. - CRC Press, 2003. - С. 473
- Гордон А., Форд Р. Спутник химика. - М.: Мир, 1976. - С. 77
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 127
- Свойства органических соединений: Справочник. - Под ред. Потехина А.А. - Л.: Химия, 1984. - С. 32-33
- Справочник по растворимости. - Т.1, Кн.2. - М.-Л.: ИАН СССР, 1962. - С. 1228
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер

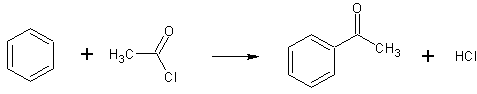
 200 г бензола и 224 г безводного хлористого алюминия помещают в круглодонную трёхгорлую колбу A ёмкостью 1 л, снабжённую мешалкой с затвором B, обратным холодильником C и капельной воронкой D. К нагреваемой на водяной бане E смеси при непрерывном перемешивании постепенно прибавляют из капельной воронки 51 г уксусного ангидрида. Реакция сопровождается энергичным выделением хлористого водорода (примеч. 1). Нагревание и перемешивание продолжается около 5 часов при температуре бани 90°.
200 г бензола и 224 г безводного хлористого алюминия помещают в круглодонную трёхгорлую колбу A ёмкостью 1 л, снабжённую мешалкой с затвором B, обратным холодильником C и капельной воронкой D. К нагреваемой на водяной бане E смеси при непрерывном перемешивании постепенно прибавляют из капельной воронки 51 г уксусного ангидрида. Реакция сопровождается энергичным выделением хлористого водорода (примеч. 1). Нагревание и перемешивание продолжается около 5 часов при температуре бани 90°.

