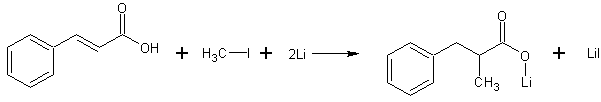Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
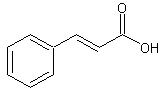
транс-3-фенилпропеновая кислота
Синонимы и иностранные названия:
zimtsaure (нем.)
коричная кислота (рус.)
транс-бета-фенилакриловая кислота (рус.)
транс-коричная кислота (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. моноклинные кристаллыБрутто-формула (по системе Хилла для органических веществ):
C9H8O2Формула в виде текста:
C6H5CH=CHCOOHМолекулярная масса (в а.е.м.): 148,159
Температура плавления (в °C):
133Температура кипения (в °C):
300Температура разложения (в °C):
350Продукты термического разложения:
этенилбензол; углерода(IV) оксид; Растворимость (в г/100 г растворителя или характеристика):
1-бутанол: 20,15 (20°C) [Лит.]
аммиак жидкий: 6,4 (20°C) [Лит.]
ацетон: 34,54 (20°C) [Лит.]
бензол: 5,93 (20°C) [Лит.]
вода: 0,1 (25°C) [Лит.]
вода: 0,588 (95°C) [Лит.]
диэтиловый эфир: легко растворим [Лит.]
изобутанол: 9,1 (19,5°C) [Лит.]
касторовое масло: 7,52 (25°C) [Лит.]
кокосовое масло: 1,77 (25°C) [Лит.]
льняное масло: 1,66 (25°C) [Лит.]
м-ксилол: 4,1 (20°C) [Лит.]
метанол: 14,9 (0°C) [Лит.]
метанол: 29 (19,5°C) [Лит.]
муравьиная кислота 95%: 3,08 (20°C) [Лит.]
оливковое масло: 1,29 (25°C) [Лит.]
пропанол: 8,9 (0°C) [Лит.]
пропанол: 15,5 (19,5°C) [Лит.]
пропанол: 22,9 (20°C) [Лит.]
тетрахлорметан: 1,36 (26°C) [Лит.]
толуол: 4,92 (20°C) [Лит.]
транс-1,2-дихлорэтилен: 1,93 (0°C) [Лит.]
уксусная кислота: растворим [Лит.]
хинолин: 1,85 (20°C) [Лит.]
хлопковое масло: 1,44 (25°C) [Лит.]
хлорбензол: 4,93 (20°C) [Лит.]
хлороформ: 4,1 (15°C) [Лит.]
цис-1,2-дихлорэтилен: 2,32 (0°C) [Лит.]
этанол: 12,7 (0°C) [Лит.]
этанол: 29 (20°C) [Лит.]
Плотность:
1,2475 (4°C, г/см3, состояние вещества - кристаллы)
Метод получения 1:
Источник информации: Гитис С.С., Глаз А.И., Иванов А.В. Практикум по органической химии: Органический синтез. - М.: Высшая школа, 1991 стр. 254-255
В сухой круглодонной колбе вместимостью 200 мл, снабженной обратным холодильником, смешивают 10 мл свежеперегнанного бензальдегида, 15 мл уксусного ангидрида, 7 г мелкораздробленного прокаленного карбоната калия. Реакционную смесь, периодически встряхивая, нагревают на песчаной или масляной бане 2 ч при температуре бани 180 С. После окончания реакции конденсации смеси дают охладиться до 100 °С (температура бани) и переливают содержимое в колбу вместимостью 500 мл, прибавляют 140 мл 2 н. раствора гидроксида натрия и отгоняют непрореагировавший бензальдегид с водяным паром. Об окончании перегонки судят по пробе на бензальдегид в дистилляте с гидросульфитом натрия.
Оставшуюся в перегонной колбе смесь охлаждают до комнатной температуры, добавляют несколько кусочков активированного угля и кипятят 10... 15 мин. Кипящий раствор быстро фильтруют на предварительно нагретой воронке для горячего фильтрования. Фильтрат охлаждают до комнатной температуры, приливают к нему концентрированную соляную кислоту до кислой реакции по бумажке конго. Образующийся кристаллический осадок отсасывают на воронке Бюхнера и сушат на воздухе.
Для получения чистой коричной кислоты ее перекристаллизовывают из горячей воды.
Выход 6 г (40,5% от теоретического).
Коричная (транс-бета-фенилакриловая) кислота — бесцветные моноклинные кристаллы с т. пл. 133°С, т. кип. 300°С. Коричная кислота легко растворима в диэтиловом эфире, растворяется в бензоле, ледяной уксусной кислоте, хлороформе (5,9 г в 100 мл при 15°С), мало растворяется в воде (0,1 г в 100 мл при 25°С; 0,588 г — при 98°С).
УФ-Спектр (в спирте) [λmax (lg e)]: 215 нм (4,28); 268 нм (4,30).
Метод получения 2:
Источник информации: Исагулянц В. Синтетические душистые вещества. - Ереван: Издательство академии наук Армянской ССР, 1946 стр. 530В железный аппарат, снабженный рубашкой для подогрева и охлаждения, мешалкой, термометром и холодильником, загружают: раствор гипохлорита, содержащий 4,5% активного хлора — 270 кг и расплавленного бензилиденацетона — 10 кг, и подогревают массу до 40°. В дальнейшем реакционная смесь саморазогревается до 60—70 С, и начинается отгонка образующегося по реакции хлороформа. Как только закончится отгонка хлороформа, реакцию окисления можно считать закончившейся. Содержимое аппарата спускают через фильтр в деревянный или керамиковый бак, в котором осаждают коричную кислоту серной кислотой. На фильтре остается около 10—15% органического вещества — дибензилиденацетона, который в условиях данной реакции не окисляется. Осажденную коричную кислоту центрофугируют, промывают и сушат. Она имеет слегка желтоватую окраску, содержит до 98°/0 коричной кислоты и для дальнейших синтезов в очистке не нуждается.
При окислении бензилиденацетона иногда образуется в виде побочного продукта некоторое количество хлорстирола — вещество с запахом гиацинтов, которое легко отделяется отгонкой паром. Коричная кислота является исходным сырьем для синтеза эфиров коричной кислоты и бромстирола.
Метод получения 3:
Источник информации: Методы элементоорганической химии: Хлор. Алифатические соединения. - М.: Наука, 1973 стр. 604Смесь 2,58 г (10 ммолей) С6Н5СНСlСН2ССl3, 2,71 г (10 ммолей) FeCl3-6H2O, 1,08 г (60 ммолей) воды и 12 г (0,2 моля) ледяной СН3СООН подвергнута кипячению в течение 6 часов. Продукт реакции охлажден, разбавлен 30 мл воды, осадок перекристаллизован из воды.
Получено 1,27 г (86% от теорет.) коричной кислоты, т. пл. 133—134° С. Из фильтрата при охлаждении выделено еще 0,06 г (4%) коричной кислоты, т. пл. 132—134° С.
Метод получения 4:
Источник информации: Ортнер Л., Рейхель Л. Практикум по органической химии. - М.-Л.: ГНТИ, 1931 стр. 92
Смесь 20 г бензойного альдегида, 10 г безводного уксуснокислого натрия и 80 г свежеперегнанного уксусного ангидрида нагревают в небольшой круглодонной колбе с обратным холодильником, снабженным хлоркальциевой трубкой, на масляной бане в течение 8 часов при 180°. Полученный продукт вливают еще горячим в полулитровую колбу, подщелачивают раствором соды и отгоняют непрореагировавший бензальдегид на водяной бане. Затем остаток дистиллята отфильтровывают от маслянистых примесей и прибавлением соляной кислоты в еще горячий раствор осаждают коричную кислоту. Путем перекристаллизации из горячей воды отсосанного после охлаждения сырого продукта, в случае надобности прибавляя немного животного угля, получают коричную кислоту с выходом в 15—20 г, в виде бесцветных призм, плавящихся при 133°.
Способы получения:
- Нагреванием до 180-200 С смеси бензилиденхлорида с ацетатом натрия. [Лит.]
- Реакция бензилиденацетона с хлорноватистой кислотой. [Лит.]
- Конденсация бензальдегида с этилацетатом в присутствии металлического натрия и следов спирта (по Кляйзену)в течение 2 часов при 0-5 С, с последующим гидролизом эфира коричной кислоты. (выход 68-74%) [Лит.]
- Реакцией бензальдегида с малоновой кислотой в спирте в присутствии аммиака, пиперидина или диэтиламина при 100 С в течение 2-4 часов. (выход 70-80%) [Лит.]
- Реакцией бензальдегида с малоновой кислотой в пиридине в присутствии следов пиперидина при 100 С в течение 1-2 часов. (выход 80-90%) [Лит.]
- Реакцией бензальдегида с этиловым эфиром бромуксуной кислоты и цинком в бензоле при 100 С в течение 1-2 часов, с полседующей перегонкой продукта для дегидратации и гидролизом сложного эфира. (выход 50-60%) [Лит.]
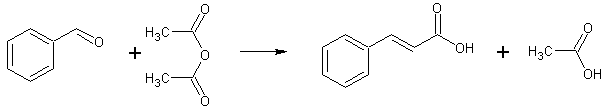
- Коричную кислоту получают реакцией бензальдегида и уксусного ангидрида в присутствии ацетата калия при 175-180 С в течение 5 часов. Выход 55 - 60%. Название реакции: реакция Перкина. [Лит.1
 ]
]
C6H5CHO + (CH3CO)2O → C6H5CH=CHCOOH + CH3COOH
- Бромбензол реагирует с акриловой кислотой в присутствии ацетата палладия(II) и трифенилфосфина при 150 С в течение 2 часов в присутствии трибутиламина с образованием коричной кислоты. Выход 74%. Название реакции: реакция Хека. [Лит.1]
C6H5Br + CH2=CHCOOH + (CH3CH2CH2CH2)3N → C6H5CH=CHCOOH + (CH3CH2CH2CH2)3NHBr
Используется для синтеза веществ:
3-фенилпропановая кислота
этенилбензол
Реакции вещества:
- В среде гексаметилфосфортриамида восстанавливается литием в присутствии иодметана до 2-метил-3-фенилпропановой кислоты. (выход 63%) [Лит.]
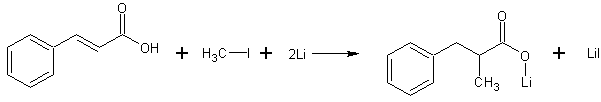
- Реагирует с диметилсульфоксидом и 30% пероксидом водорода в присутствии дигидрата хлорида меди(II), хлорида кальция, карбоната калия и кислорода при 80 С в течении 15 часов с образованием метилового эфира коричной кислоты. (выход 37%) [Лит.]
- Реагирует с хлоридами арилдиазония с образованием 1-арил-2-фенилэтенов. [Лит.]
- Реагирует с пероксомоносульфатом калия в смеси ацетон-вода с образованием транс-эпоксида коричной кислоты. (выход 95%) [Лит.]
- Реагирует с хлором в водном растворе карбоната натрия с образованием гидроксихлоркоричной кислоты, которая при кипячении с гидроксидом натрия дает фенилуксусный альдегид. [Лит.]
- Сульфируется в пара-положение. [Лит.]
- При 150 С декарбоксилируется до стирола. [Лит.]
- Восстанавливается до дигидрокоричной кислоты. [Лит.]
- Окисляется в смесь бензойной и уксусной кислот. [Лит.]
- Нитруется в ядро с образованием смеси нитрокоричных кислот. [Лит.]
- При длительном освещении димеризуется с образованием смеси труксилловой и труксиновой кислот. [Лит.]
- Легко присоединяет бром с образованием дибромгидрокоричной кислоты, которая при нагревании с раствором соды или поташа превращается в β-бромстирол. [Лит.]
- В безводном этаноле присоединяет гидроксиламин с образованием 3-(N-гидроксиамино)-3-фенилпропановой кислоты, которая при дальнейшем кипячении с гидроксиламином дает 3-амино-3-фенилпропановую кислоту. (выход 84%) [Лит.]
- Коричная кислота восстанавливается алюмогидридом лития до 3-фенил-1-пропанола. Выход 85%. [Лит.1]
Показатели диссоциации:
pKa (1) = 4,438 (25°C, вода)
Летальная доза (ЛД50, в мг/кг):
2500 (крысы, перорально)
1600 (крысы, внутрибрюшинно)
Дополнительная информация:
Соли и эфиры коричной кислоты называются циннаматами.
Источники информации:
- Beilsteins Handbuch der Organischen Chemie. - Vierte Auflage, 9 Band. - Berlin: Verlag von Julius Springer, 1926. - С. 573-580
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 625-629
- Stahl P.H., Wermuth C.G. Handbook of Pharmaceutical Salts: Properties, Selection, and Use. - Wiley-VCH, 2002. - С. 277-278
- Свойства органических соединений: Справочник. - Под ред. Потехина А.А. - Л.: Химия, 1984. - С. 334-335
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 505-506, 911
- Справочник по растворимости. - Т.1, Кн.2. - М.-Л.: ИАН СССР, 1962. - С. 1032, 1112, 1524, 1527-1528
- Справочник химика. - 2 изд., Т. 2. - Л.-М.: Химия, 1964. - С. 730-731
- Химическая энциклопедия. - Т. 2. - М.: Советская энциклопедия, 1990. - С. 472
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер