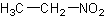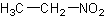Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
нитроэтан
Синонимы и иностранные названия:
nitroethane (англ.)
Тип вещества:
органическое
Внешний вид:
бесцветн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
C2H5NO2Формула в виде текста:
CH3CH2NO2Молекулярная масса (в а.е.м.): 75,067
Температура плавления (в °C):
-89,52Температура кипения (в °C):
114,1Температурные константы смесей (содержание в весовых процентах):
87,22 °C (температура кипения азеотропа, давление 1 атм) вода 28,5% нитроэтан 71,5%
Растворимость (в г/100 г растворителя или характеристика):
ацетон: растворим [Лит.]
вода: 4,6 (20°C) [Лит.]
вода: 5,6 (50°C) [Лит.]
диэтиловый эфир: смешивается [Лит.]
хлороформ: растворим [Лит.]
этанол: смешивается [Лит.]
Плотность:
1,05057 (20°C, г/см3, состояние вещества - жидкость)
Некоторые числовые свойства вещества:
Магнитная восприимчивость (мм3/моль): -0,0354
Нормативные документы, связанные с веществом:
- Постановление правительства РФ № 1020 от 08.10.2012 "Об утверждении крупного и особо крупного размеров прекурсоров наркотических средств или психотропных веществ, а также крупного и особо крупного размеров для растений, содержащих прекурсоры наркотических средств или психотропных веществ, либо их частей, содержащих прекурсоры наркотических средств или психотропных веществ, для целей статей 228_3, 228_4 и 229_1 Уголовного кодекса Российской Федерации"
- крупный размер (г, свыше) = 20 (в концентрации 40 процентов или более, с изменениями на 09.04.2015)
- особо крупный размер (г, свыше) = 3000 (в концентрации 40 процентов или более, с изменениями на 09.04.2015)
- Постановление правительства РФ № 681 от 30.06.1998 "Об утверждении перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации" (Описание документа: Списки наркотических и психотропных веществ.)
- список = 4 (прекурсор, таблица I, с концентрацией 40% и более, с изменениями на 09.04.2015)
Используется для синтеза веществ:
1-(3,4-диметоксифенил)-2-нитропропен-1
2-метокси-4-(2-нитропроп-1-енил)фенол
Реакции вещества:
- При реакции с концентрированными щелочами образует 3,4,5-триметилизоксазол. [Лит.]
Показатель преломления (для D-линии натрия):
1,3919 (20°C)
Давление паров (в мм рт.ст.):
20 (15,56°C)
Показатели диссоциации:
pKa (1) = 8,44 (25°C, вода)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-143,9 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
134,4 (ж)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-103,8 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
320,5 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
79 (г)Летальная доза (ЛД50, в мг/кг):
860 (мыши, )
Критическая температура (в °C):
388,6Применение:
Растворитель (например восков, жиров).
Дополнительная информация::
Нижний КПВ 4,0%. Не образует азеотропов с этилнитратом, 2-хлорэтанолом, м-ксилолом, бутилацетатом, бензолом, 1,4-диоксаном, 1-хлор-2-пропанолом, пропионовой кислотой.
Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 5-22
- Dean J.A. Lange's handbook of chemistry. - 1999. - С. 1.284
- Flick E.W. Industrial solvent handbook. - 5ed. - 1998. - С. 211-212, 216
- Огородников С.К., Лестева Т.М., Коган В.Б. Азеотропные смеси: Справочник. - Л.: Химия, 1971. - С. 218-220
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 168
- Справочник химика. - Т. 3. - М.-Л.: Химия, 1965. - С. 390-391
- Химическая энциклопедия. - Т. 3. - М.: Советская энциклопедия, 1992. - С. 279
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 389
- Энергетические конденсированные системы. - Под ред. Жукова Б.П., 2-е изд. - М.: Янус-К, 2000. - С. 323-324
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер