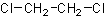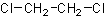Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
1,2-дихлорэтан
Синонимы и иностранные названия:
1,2-dichloroethane (англ.)
дихлорэтан (рус.)
этилендихлорид (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
C2H4Cl2Формула в виде текста:
ClCH2CH2ClМолекулярная масса (в а.е.м.): 98,95
Температура плавления (в °C):
-35,87Температура кипения (в °C):
83,47Растворимость (в г/100 г растворителя или характеристика):
ацетон: растворим [Лит.]
бензол: растворим [Лит.]
вода: 0,92 (0°C) [Лит.]
вода: 0,81 (20°C) [Лит.]
вода: 0,865 (25°C) [Лит.]
вода: 1,06 (50°C) [Лит.]
вода: 2,22 (100°C) [Лит.]
диэтиловый эфир: смешивается [Лит.]
этанол: растворим [Лит.]
Плотность:
1,2576 (17°C, г/см3, состояние вещества - жидкость)
1,257 (20°C, относительно воды при 4°C, состояние вещества - жидкость)
Нормативные документы, связанные с веществом:
- ГОСТ № 31951-2012 "Вода питьевая. Определение содержания летучих галогенорганических соединений газожидкостной хроматографией." (Описание документа: Определение галогенуглеводородов экстракцией гексаном или парофазным анализом в питьевой воде и воде подземных водоисточников.)
- нижняя граница диапазона определения (мг/дм3) в питьевой воде = 0,001 (парофазным методом)
- верхняя граница диапазона определения (мг/дм3) в питьевой воде = 0,02 (парофазным методом)
- ГОСТ Р № 51392-99 "Вода питьевая. Определение содержания летучих галогенорганических соединений газожидкостной хроматографией" (Описание документа: Анализ воды ГХ после экстракции гексаном или парофазным методом.)
- ГОСТ Р ИСО № 16017-1-2007 "Воздух атмосферный, рабочей зоны и замкнутых помещений. Отбор проб летучих органических соединений при помощи сорбционной трубки с последующей термодесорбцией и газохроматографическим анализом на капиллярных колонках. Часть 1. Отбор проб методом прокачки"
- Гигиенические нормативы (ГН) № 2.1.5.2280-07 "Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования. Дополнения и изменения №1" (Описание документа: ПДК в питьевой воде; Документ устарел.)
- предельно допустимая концентрация (мг/л) в питьевой воде = 0,003 (канцероген, санитарно-токсикологический показатель)
- МУК № 4.1.618-96 "Методические указания по хромато-масс-спектрометрическому определению летучих органических веществ в атмосферном воздухе"
- ПНД Ф № 14.1:2:4.71-96 "Методика выполнения измерений массовых концентраций летучих галогенорганических соединений в пробах питьевых, природных и сточных вод методом газовой хроматографии"
Метод получения 1:
Источник информации: Методы элементоорганической химии: Хлор. Алифатические соединения. - М.: Наука, 1973 стр. 292В трубку (высота 1250 мм, диаметр 38 мм), заполненную железной проволокой и дихлорэтаном, пропущено в течение 172 минут 392 л 97%-ного этилена и 395 л хлора. Образующийся дихлорэтан поступал в колонку (высота 1000 мм, диаметр 30 мм) где он контактировал с этиленом. Получено 1585 г дихлорэтана (99% выход на этилен); конверсия этилена 99,1%. Для очистки продукта от примесей хлора, хлороводорода и хлоридов железа на него действуют этиленом и водой или продувают аммиаком (0,44 г аммиака).
Используется для синтеза веществ:
этан-1,2-диамин
Реакции вещества:
- При взаимодействии 1,2-дихлорэтана с цианистым натрием в спиртовой среде получается сукциннитрил. [Лит.]
ClCH2CH2Cl + 2NaCN → NCCH2CH2CN + 2NaCl
- Реагирует с ацетатом натрия с образованием этиленгликольдиацетата. [Лит.]
ClCH2CH2Cl + 2CH3COONa → CH3COOCH2CH2OCOCH3 + 2NaCl
- В водных или спиртовых средах в присутствии солей аммония 1,2-дихлорэтан реагирует с аммиаком, давая этилендиамин. [Лит.]
ClCH2CH2Cl + 4NH3 → H2NCH2CH2NH2 + 2NH4Cl
- В присутствии катализаторов Фриделя-Крафтса реагирует с бензолом с образованием 1,2-дифенилэтана. [Лит.]
ClCH2CH2Cl + 2C6H6 → C6H5CH2CH2C6H5 + 2HCl
- Реагирует с хлором в жидкой или паровой фазе в присутствии радикальных инициаторов с образованием 1,1,2-трихлорэтана. [Лит.]
- Действие воды в присутствии кислот или щелочей при 140-250°С и давлении до 4 МПа приводит к гидролизу 1,2-дихлорэтана с образованием этиленгликоля. [Лит.]
- При действии спиртовых или водных растворов щелочей или при нагревании выше 250°С от 1,2-дихлорэтана отщепляется хлористый водород с образованием винилхлорида. [Лит.]
- При взаимодействии с олеумом образуется 2-хлорэтилсульфурилхлорид. [Лит.]
- Полисульфид натрия реагирует с 1,2-дихлорэтаном, образуя каучукоподобные материалы - полиэтилентетрасульфиды (тиокол). [Лит.]
- В присутствии хлорида бария разлагается при 250 С с образованием винилхлорида и хлороводорода. [Лит.]
- Смесь азотной кислоты с 1,2-дихлорэтаном детонирует от нагрева, удара и трения. [Лит.1]
Показатель преломления (для D-линии натрия):
1,4448 (20°C)
Давление паров (в мм рт.ст.):
20 (63°C)
Диэлектрическая проницаемость:
10,36 (20°C)
Дипольный момент молекулы (в дебаях):
1,75 (20°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
0,887 (15°C)
0,73 (30°C)
Поверхностное натяжение (в мН/м):
32,23 (20°C)
23,4 (35°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-166,1 (ж)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-80,33 (ж)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
208,53 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
129 (ж)Энтальпия плавления ΔHпл (кДж/моль):
0,87Энтальпия кипения ΔHкип (кДж/моль):
31,45Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-126,4 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
308,4 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
78,7 (г)Летальная доза (ЛД50, в мг/кг):
770 (крысы, перорально)
Симптомы острого отравления:
Человек. Среди всех случаев острых отравлений органическими растворителями на долю 1,2-дихлорэтана приходится 44%, из них 5% - в быту. Отравление 1,2-дихлорэтаном относится к самому тяжелому виду интоксикаций: в 80% случаев - летальный исход. Клинические проявления зависят от способа поступления яда. Наименее выражено токсическое действие при поступлении через неповрежденную кожу.
При ингаляционном отравлении парами вначале поражаются нервная система и дыхательные пути; после скрытого периода пострадавшие жалуются на головную боль, головокружение, общую слабость, кашель, жжение в горле, слезотечение, кожный зуд, ощущение горечи во рту, боли в области сердца. Появляются тошнота и рвота, которая может длиться по несколько часов. У пострадавших отмечается бледность кожных покровов, желтушность склер, затемненное сознание, брадикардия, иногда расстройство зрения. На 2—3 дни нарушается деятельность печени. Она увеличивается, становится болезненной, появляется гипербилирубииемия.
Воздействие в концентрациях 6, 12, 23 и 50 мг/м3 в течение 15 мин вызывает характерные изменения плетизмограммы, выражающиеся в увеличении количества пульсовых ударов, пульсовых волн и их высоты. При вдыхании 100—200 мг/м3 в течение 6 ч жалобы на тошноту, тяжесть в желудке. Концентрации 300—600 мг/м3 в течение 2—3 ч вызывают головную боль, сонливость, сладкий вкус во рту, тошноту, рвоту, легкое раздражение слизистых оболочек, покраснение кожи лица, иногда ощущение жжения. На следующий день сохраняется лишь ощущение слабости. При содержании в воздухе 1250—2750 мг/м3 работу приходится проводить в противогазах. После 30-мин пребывания в помещении с концентрацией дихлорметана 250 000 мг/м3 резкая слабость, головная боль, сильная икота, повторная рвота, редкий и слабый пульс, понос, потеря сознания. На 2 день бред, повышение содержания белка в моче, уменьшение количества мочи. На 3 день в моче цилиндры, в крови высокий уровень остаточного азота (81,6 мг%). На 4—5 дни желтушность и болезненность печени, анемия. На 7 день смерть от отека легких. Известно развитие после острых отравлений токсических менингоэнцефалитов и энцефалопатии, заканчивающихся многолетней инвалидностью, а также параличами.
Наиболее тяжелые отравления наблюдаются при приеме 1,2-дихлорэтана внутрь. Они развиваются при дозах 5—200 мл. Минимальная смертельная доза для человека находится на уровне 10—30 мл (Бережной; Меркулов; Эйтингон). Клиника отравлений в этих случаях подразделяется на три периода: скрытый, мозговых явлений и печеночно-почечный. Отличительная особенность клинической картины острого в/ж отравления дихлорэтаном — чрезвычайно короткий скрытый период, часто он длится 5—10 мин, реже — от 10 мин до 3 ч и более. Первые жалобы пострадавших чаще всего сводятся к сильным болям в животе, тошноте и рвоте, иногда неукротимой, с примесью желчи и крови. В 50 % случаев вслед за появлением первых симптомов больные в течение 10—15 мин теряют сознание. Наибольшее количество смертельных исходов наблюдается в течение 1 сут.
В клинической картине острого в/ж отравления выделяют четыре ведущих синдрома: токсическая энцефалопатия (на первый план выступают психомоторное возбуждение, напоминающее алкогольное опьянение, судороги, затем угнетение психики с развитием коматозного состояния); острый гастрит и гастроэнтерит; острая сердечно-сосудистая недостаточность с падением артериального давления; острый токсический гепатит с явлениями печеночно-почечной недостаточности. Вначале развивается печеночная недостаточность. В тяжелых случаях токсический гепатит характеризуется резкими болями в правом подреберье, многократной рвотой, выраженной желтухой, увеличением печени на 4—6 см, увеличением билирубина до 15—20 мг% и более, повышением активности трансаминаз от 600—800 ед. до нескольких тысяч, снижением протромбинового индекса до 10—12 % и ниже, гипохолестеринемией; наибольшая выраженность изменений наблюдается на 4—6 сут; при благополучном исходе восстановление начинается с 7—8 сут. Почечная недостаточность, развивающаяся вслед за печеночной, сопровождается резким уменьшением количества выделяемой мочи. В ряде случаев развивается анурия.
Количество белка в моче достигает 6,6 %. При микроскопии осадка: многочисленные эритроциты, лейкоциты, цилиндры. В некоторых случаях острая почечная недостаточность быстро прогрессирует, и через 4—5 дней развивается уремическая кома. Динамику интоксикации и прогноз определяет характер ЭЭГ.
В случаях смерти в первые 10—12 ч при наружном осмотре трупа не отмечается каких-либо особенностей. При патолого-анатомическом исследовании: запах прелых и сушеных грибов, чеснока, хлороформа. При исследовании головного мозга обращает внимание выраженность отечного и гипоксического синдромов. Во внутренних органах застойное полнокровие, признаки сосудистых расстройств, отеки, кровоизлияния, иногда набухание, гиперемия и некрозы слизистой желудка и тонких кишок. При более поздней смерти проявляется липотропное действие дихлорэтана, обнаруживаются дистрофические, воспалительные и некротические изменения внутренних органов (Бережной; Меркулов).
Критическая температура (в °C):
288Критическое давление (в МПа):
5,37Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 5-22
- Journal of Physical and Chemical Reference Data. - 1999. - Vol. 28, No. 2. - С. 580-610 (растворимость в воде и водных растворах неорганических веществ)
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 98-99
- Yalkowsky S.H., Yan H., Jain P. Handbook of aqueous solubility data. – 2nd ed. - CRC Press, 2010. - С. 30
- Промышленные хлорорганические продукты: Справочник. - М.: Химия, 1978. - С. 100-110
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 381
- Справочник химика. - 2 изд., Т. 2. - Л.-М.: Химия, 1964. - С. 1142-1143
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер