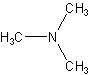

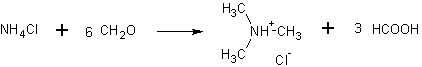
25 г хлористого аммония и 66,5 г параформальдегида тщательно смешивают и помещают в круглодонную колбу емкостью 500 мл, соединенную с длинным обратным холодильником, имеющим широкую внутреннюю трубку.
Реакция сопровождается выделением большого количества тепла, поэтому, во избежание потерь, необходим длинный холодильник (70—80 см). Широкая внутренняя трубка (~1,5 см) нужна для того, чтобы возгоняющийся параформальдегид не мог ее закупорить.
Реакционную смесь постепенно нагревают на масляной бане. При температуре от 85 до 105° С масса на дне колбы начинает плавиться и одновременно, начинается очень бурное выделение углекислого газа. Нагревание немедленно прекращают и, если реакция идет слишком бурно, удаляют масляную баню. Реакции дают возможность продолжаться без дальнейшего нагревания до тех пор, пока выделение газа не замедлится, что происходит через ~ 1,5 ч. После этого возобновляют нагревание, постепенно повышая температуру масляной бани до 160° С; температуру поддерживают на этом уровне до тех пор, пока выделение углекислого газа практически не прекратится, на что требуется 2,5—3,5 ч; после этого реакцию можно считать законченной.
Для получения солянокислого триметиламина реакционную смесь нужно обработать едким натром и отогнать свободный амин в соляную кислоту. Для этого прекращают нагревание, удаляют обратный холодильник и снабжают колбу длительной воронкой и прямым холодильником. К нижнему концу последнего в качестве приемника герметически присоединяют колбу Вюрца или склянку для отсасывания. Отводную трубку приемника при помощи резиновой трубки соединяют с доходящей до дна трубкой промывалки, в которую налита соляная кислота. Необходимо тщательно следить за тем, чтобы все соединения прибора были достаточно герметичны, так как триметиламин очень летуч. Колба Вюрца служит для улавливания воды, которая отгоняется вместе с триметиламином при обработке щелочью. Эта вода часто окрашена в желтый цвет; при непосредственном попадании в соляную кислоту она может загрязнить солянокислый триметиламин.
К несколько остывшей во время сборки прибора реакционной массе медленно по каплям приливают через делительную воронку раствор 55 г едкого натра в 100 мл воды (это количество превышает в 2,5—3 раза теоретически необходимое для выделения свободного амина). При этом амин отгоняется, проходит через холодильник и колбу Вюрца и поглощается соляной кислотой — берут 50 мл кислоты (d=l,19), т. е. несколько больше, чем это необходимо для нейтрализации теоретического выхода амина. Чтобы быть уверенным, что в реакционной колбе не осталось амина, после прибавления всего количества едкого натра смесь нагревают в течение 10—15 мин. На всю операцию от начала синтеза до окончания отгонки триметиламина требуется не более 6—7 ч.
Для выделения солянокислого триметиламина полученный кислый раствор упаривают сначала на голом пламени, а затем, когда начнут выпадать кристаллы, на водяной бане. По мере того как раствор концентрируется, выпадает все больше и больше кристаллов солянокислого триметиламина, их периодически отсасывают, сушат в течение нескольких минут в сушильном шкафу при 100—110° С, а затем помещают в плотно закрывающуюся склянку. Фильтрат снова упаривают, выпавшие кристаллы отсасывают, сушат и т. д. Путем центрифугирования солянокислого триметиламина можно сразу получить чистый и сухой продукт.
Выход — 35 г (80%).
Полученный продукт нацело растворяется в хлороформе и, следовательно, ие содержит ни хлористого аммония, ни солянокислого металамина. Отсутствие солянокислого диметиламина доказывается тем, что при обработке водного раствора продукта бензолсульфохлоридом и едким натром ие образуется никакого осадка.
Придает запах селедочному рассолу и цветам некоторых видов боярышника.