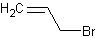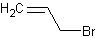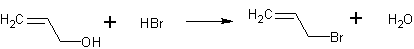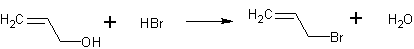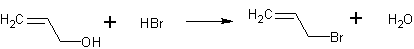Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
3-бромпропен
Синонимы и иностранные названия:
2-пропенилбромид (рус.)
3-bromopropene (англ.)
allyl bromide (англ.)
аллил бромистый (рус.)
аллилбромид (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
C3H5BrФормула в виде текста:
CH2=CHCH2BrМолекулярная масса (в а.е.м.): 120,98
Температура плавления (в °C):
-119,4Температура кипения (в °C):
71,3Температурные константы смесей (содержание в весовых процентах):
54 °C (температура кипения азеотропа, давление 1 атм) 3-бромпропен 79,5% метанол 20,5%
56,05 °C (температура кипения азеотропа, давление 1 атм) 3-бромпропен 8% пропан-2-он 92%
66,9 °C (температура кипения азеотропа, давление 1 атм) 3-бромпропен 45% гексан 55%
69,2 °C (температура кипения азеотропа, давление 1 атм) 3-бромпропен 92% проп-2-ен-1-ол 8%
Растворимость (в г/100 г растворителя или характеристика):
вода: 0,3835 (25°C) [Лит.]
диэтиловый эфир: смешивается [Лит.]
сероуглерод: растворим [Лит.]
тетрахлорметан: растворим [Лит.]
хлороформ: растворим [Лит.]
этанол: смешивается [Лит.]
Плотность:
1,398 (20°C, относительно воды при 4°C, состояние вещества - жидкость)
Некоторые числовые свойства вещества:
Летальная концентрация в воздухе для 50% животных (ЛК50, мг/л): 4,11 (белые мыши, экспозиция 2 ч)
Летальная концентрация в воздухе для 50% животных (ЛК50, мг/л): 10 (крысы, экспозиция 2 ч)
Нижний концентрационный предел взрываемости газов, паров или пыли в воздухе (%): 2,7
Метод получения 1:
Источник информации: Губен И. Методы органической химии. - Т. 3, Вып. 3. - М.: Главная редакция химической литературы, 1935 стр. 410-411
Газообразный бромоводород пропускают при охлаждении в аллиловый спирт до полного насыщения. Бромистый аллил выделяется в виде тяжелого темноватого маслянистого слоя. Продолжительным кипячением с обратным холодильником реакцию доводят до конца. Аллилбромид очищают промыванием разбавленным едким натром и водой и сушат над хлористым кальцием.
Выход 1620 г аллилбромида из 840 г аллилового спирта (93%, теоретически должно получится 1734 г аллилбромида).
Метод получения 2:
Источник информации: Органикум. - Т.1. - М.: Бином, 2008 стр. 284
К 1 моль аллилового спирта добавляют при охлаждении 1,5 моль 48%-ной свежеперегнанной бромоводородной кислоты и доводят смесь до кипения. Аллилбромид отгоняют (20-см колонка Вигре, нисходящий холодильник, скорость перегонки 2-3 капли/с). Выход 80%.
Метод получения 3:
Источник информации: Синтезы органических препаратов. - Ч. 1. - М., 1949 стр. 110
В 3-литровую круглодонную колбу вливают или раствор бромистоводородной кислоты, полученный восстановлением сернистым газом 480 г (150,5 мл; 3 мол.) брома в 510 г воды со льдом, или же смесь 1 кг (5,9 мол.) водной 48%-ной бромистоводородной кислоты с 300 г (162 мл) концентрированной серной кислоты. Затем добавляют 385 мл водного аллилового спирта, содержащего по данным титрования бромом 233 г (4 мол.) чистого аллилового спирта. Колба снабжена механической мешалкой (для уменьшения расслаивания смеси), делительной воронкой и эффективно действующим нисходящим холодильником. Пускают в ход мешалку и постепенно к теплому раствору прибавляют с помощью делительной воронки 300 г (162 мл) концентрированной серной кислоты. При этом бромистый аллил отгоняется полностью в течение 30—60 минут. Сырой продукт промывают разбавленным раствором соды, сушат хлористым кальцием и перегоняют.
Выход бромистого аллила с т. кип. 69—72 С колеблется в пределах от 445 до 465 г (92—96% теоретич.). Наряду с этим получается высококипящая фракция, состоящая из бромистого пропилена.
Используется для синтеза веществ:
N,N-ди(проп-2-ен-1-ил)цианамид
проп-2-еноксибензол
Реакции вещества:
- Реагирует с бромоформом и гидроксидом калия в присутствии спирта и соли (2-гидроксиэтил)бензилдиметиламмония с образованием 1,1-дибром-2-(бромметил)циклопропана. (выход 51%) [Лит.]
Показатель преломления (для D-линии натрия):
1,4660 (20°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
12,2 (ж)Температура вспышки в воздухе (°C):
-1Температура самовоспламенения на воздухе (°C):
295Стандартная энтальпия образования ΔH (298 К, кДж/моль):
45,2 (г)Летальная доза (ЛД50, в мг/кг):
30 (морские свинки, перорально)
108 (мыши, внутрибрюшинно)
Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 5-23
- Lewis R.J. Sax's Dangerous Properties of Industrial Materials. - 11ed. - Wiley-interscience, 2004. - С. 111
- Yalkowsky S.H., Yan H., Jain P. Handbook of aqueous solubility data. – 2nd ed. - CRC Press, 2010. - С. 52
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 122
- Справочник химика. - 2 изд., Т. 2. - Л.-М.: Химия, 1964. - С. 410-411
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 25
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер