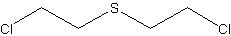Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
бис(2-хлорэтил)сульфид
Синонимы и иностранные названия:
2,2'-дихлордиэтилсульфид (рус.)
EA 1033 (англ.)
mustard gas (англ.)
бис-бета-хлорэтилсульфид (рус.)
горчичный газ (рус.)
иприт (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. маслянистая жидкостьБрутто-формула (по системе Хилла для органических веществ):
C4H8Cl2SФормула в виде текста:
S(CH2CH2Cl)2Молекулярная масса (в а.е.м.): 159,08
Температура плавления (в °C):
14,5Температура кипения (в °C):
217Температура разложения (в °C):
217Растворимость (в г/100 г растворителя или характеристика):
бензол: растворим [Лит.]
вода: 0,8 (20°C) [Лит.]
диэтиловый эфир: растворим [Лит.]
этанол абсолютный: 81,26 (5,6°C) [Лит.]
Плотность:
1,2741 (20°C, г/см3, состояние вещества - жидкость)
Вкус, запах, гигроскопичность:
запах: горчицы
Некоторые числовые свойства вещества:
Год открытия: 1886 (Майер В.)
Нормативные документы, связанные с веществом:
- Гигиенические нормативы (ГН) № 1.1.725-98 от 23.12.1998 "Перечень веществ, продуктов, производственных процессов, бытовых и природных факторов, канцерогенных для человека."
- канцероген = (с доказанной канцерогенностью для человека)
- Санитарные правила и нормы (СанПиН) № 1.2.3685-21 от 28.01.2021 "Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания" (Описание документа: ПДК веществ)
- ориентировочно безопасный уровень воздействия (мг/м3) в атмосферном воздухе населенных мест = 0,000002
Реакции вещества:
- При хлорировании в воде при освещении образует 2-хлорэтансульфохлорид. (выход 51%) [Лит.]
- Реагирует с метантиолатом натрия с образованием бис(метилтиоэтил)сульфида. (выход 80%) [Лит.]
- Реагирует с хлором при -5 - 0 С в тетрахлорметане с образованием хлорида бис(2-хлорэтил)хлорсульфония. [Лит.]
- С цианидом калия образует этилен-1,2-бис(3-тиопропаннитрил). [Лит.]
- Хлорируется хлором при повышенной температуре с образованием гексахлорэтана, хлороводорода и дихлорида серы. [Лит.]
- Медленно реагирует с сухим аммиаком при 150 С с образованием тиоморфолина. [Лит.]
- С концентрированной азотной кислотой образует бис(2-хлорэтил)сульфоксид. [Лит.]
- При нагревании с концентрированной серной кислотой образуется 2-хлорэтансульфоновая кислота. [Лит.]
- Под действием перуксусной кислоты, пербензойной кислоты, перманганата калия или дихромата калия окисляется до бис(2-хлорэтил)сульфона с кожно-нарывным действием равным иприту. [Лит.]
- Реагирует с бромидом натрия в ацетоне с образованием бис(2-бромэтил)сульфида. [Лит.]
- Реагирует с иодидом натрия в уксусной кислоте с образованием бис(2-иодэтил)сульфида. [Лит.]
- С избытком фторида серебра при 40-50 С в течение 1 часа образует бис(2-фторэтил)сульфид. [Лит.]
- Дает осадки с хлоридами платины(IV), золота(III), ртути(II). [Лит.]
- С раствором хлорида платины(II) дает осадок комплекса, растворимого в горячей воде. [Лит.]
- Очень медленно гидролизуется с образованием сульфониевых солей. [Лит.]
- При нагревании в запаянной трубке при 180 С в течение 18 часов разлагается на дихлорэтан и дитиан. [Лит.]
- С сульфидом натрия образует дитиан с небольшим выходом. [Лит.]
- Реагирует со спиртовым раствором гидроксида калия с образованием дивинилсульфида. [Лит.]
- При нагревании с концентрированным раствором тиомочевины в течение 15 минут образуется изотиурониевая соль. [Лит.]
- С иодметаном образует иодид S-метилдитиана. [Лит.]
Реакции, в которых вещество не участвует:
- При комнатной температуре не реагирует с алюминием, железом, цинком, оловом, свинцом, латунью, бронзой. [Лит.]
- При 100 С не действует на алюминий, олово и латунь. [Лит.]
Показатель преломления (для D-линии натрия):
1,5293 (20°C)
Давление паров (в мм рт.ст.):
0,024 (0°C)
0,055 (10°C)
0,115 (20°C)
0,23 (30°C)
0,45 (40°C)
0,83 (50°C)
1,55 (60°C)
10 (90°C)
20 (110°C)
200 (180°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
4,4 (20°C)
Логарифм давления насыщенного пара (в мм рт.ст.): lg p = 8,3937 - 3734/T (при T = 273-313 K)
Летальная доза (ЛД50, в мг/кг):
1-2 (собаки, перорально)
70 (человек, накожно)
Симптомы острого отравления:
Иприт обладает четко выраженным местным действием на все органы и ткани, оказавшиеся в контакте с ним - на глаза и дыхательные пути, на кожу и желудочно-кишечный тракт. Вместе с тем иприту присуще значительное общеядовитое действие в результате всасывания его с пораженного участка тела в кровь. Токсическое действие проявляется как у капельно-жидкого ОВ, так и у его пара и аэрозолей.
Попадание на кожу капель или аэрозолей иприта, равно как и контакт кожных покровов с парообразным ОВ, первоначально не вызывает никаких неприятных ощущений. В течение первых 2—5 мин иприт преодолевает верхние слои кожи, через 7—10 мин он растворяется в подкожной жировой клетчатке, а через 20—30 мин полностью всасывается и попадает в кровяное русло. После всасывания наступает период скрытого действия ОВ продолжительностью от двух часов до суток в зависимости от дозы ОВ, температуры и влажности воздуха, структуры и влажности кожи. В течение всего периода скрытого действия пораженные не наблюдают болевых ощущений или других признаков токсического действия.
В жаркую погоду, в случае горячей, влажной кожи или нежных ее участков период скрытого действия значительно сокращается и может практически отсутствовать. Скорость резорбции иприта через кожу при температуре 21—23 С составляет 1,4 мкг/(мин • см2), а при более высокой температуре — 2,7 мкг/(мин • см2).
Первые признаки поражения после окончания периода скрытого действия проявляются в виде зуда, жжения и покраснения кожи (эритемы) в местах ее контакта с жидким или парообразным ипритом. Кожа натягивается, становится сухой и теплой. При небольших дозах эти явления через несколько суток проходят. При более высоких дозах развивается отечность, по краям которой спустя 16—30 ч после воздействия иприта появляется множество мелких пузырьков. В дальнейшем эти пузырьки сливаются в более крупные или в один большой пузырь с бесцветной или желтоватой жидкостью. Пузыри обычно прорываются, и на коже образуются болезненные ипритные язвы, заживление которых может продолжаться 1—2 мес и более. Вторичная инфекция может привести к гнойным воспалениям пораженных участков кожи. На месте этих участков остаются рубцы.
Если суммарная площадь пораженных участков тела не превышает 20 см2, то общее смертельное отравление вследствие кожной резорбции иприта маловероятно. Поражающее действие пара иприта на кожу редко выходит за стадию эритемы и образования мелких пузырьков. Экспериментально показано, что в случае нахождения обнаженного предплечья, в атмосфере с относительной влажностью 46%, насыщенной парами иприта, для образования пузырей с 50% вероятностью достаточно, чтобы через кожу проникло 0,006 мг ОВ. Эритема возникает при значении Ст = 0,2 мг * мин/л, пузыреобразование — 2 мг * мин/л, а для смертельного отравления парообразным ипритом это значение должно составлять 10 мг * мин/л. Большие количества всосавшегося иприта, попадая с током крови во внутренние органы, вызывают их поражения, сопровождающиеся кровотечениями. В итоге возникают тяжелые или смертельные отравления организма.
В случае контакта кожи с жидким ипритом покраснение кожи наблюдается при плотности заражения 0,01 мг/см2, мелкие пузырьки образуются при плотности 0,1—0,15 мг/см2 и крупные — при 0,5 мг/см2. Смертельная токсодоза при кожной резорбции ЛД50 = 70 мг/кг.
Очень чувствительны к иприту глаза. При попадании в глаза капель или аэрозоля ОВ уже через 30 мин появляются чувство жжения, зуд и усиливающиеся боли. Поражение быстро развивается в глубину и большей частью завершается потерей зрения.
Первые признаки поражения глаз парами ипритом появляются через 4—8 ч в виде спазма век, слезотечения, чувства засоренности глаз, светобоязни, воспаления конъюнктивы, которое может сохраняться до месяца. Для подобного поражения глаз достаточно 45-минутного пребывания в атмосфере с концентрацией иприта около 0,001 мг/л. В дальнейшем наблюдается смыкание век и склеивание их вязкой жидкостью. Возможна потеря зрения вследствие помутнения роговицы. При Ст 0,15 мг * мин/л живая сила выходит из строя через 4—6 ч из-за сильного воспаления конъюнктивы, сопровождающегося эритемой кожи.
Вдыхание пара и аэрозоля иприта в невысоких концентрациях приводит через 6—8 ч к легкому воспалению верхних дыхательных путей, першению в горле, сухому кашлю, бронхиту, явлениям катара, продолжающимся 3—4 сут. Более высокие концентрации ОВ уже через 3 ч вызывают мучительный кашель, потерю голоса, боли в груди, затруднение глотания, позывы к рвоте, кровотечения в дыхательных путях и, наконец, отек легких. Общее отравление проявляется в подъеме температуры тела, апатии, слабости и упадке сил. Тяжелые поражения через 3—4 дня заканчиваются смертельным исходом. При отравлениях средней тяжести смерть может наступить через 1—4 недели. Относительная токсичность при ингаляции LCt50 1.5 мг * мин/л с периодом скрытого действия от 4 ч до суток.
При попадании иприта в организм вместе с зараженной пищей или водой через 15—20 мин возникают сильные боли в желудке, сопровождающиеся слюнотечением и рвотой, кровавым поносом и жаждой. Кожа бледнеет, возможны обморочные состояния. Вследствие общего отравления организма примерно через двое суток наступает смертельный исход. Среднесмертельная токсодоза при пероральном поступлении LD50 1—2 мг/кг (собаки).
Иприт обладает кумулятивными свойствами.
Применение:
Боевое отравляющее вещество кожно-нарывного действия.
Источники информации:
- Ellison D.H. Handbook Of Chemical And Biological Warfare Agents. - 2ed., 2008. - С. 156, 654
- Introduction to Military Toxicology: a crush course 2001. - С. 35-37
- Lewis R.J. Sax's Dangerous Properties of Industrial Materials. - 11ed. - Wiley-interscience, 2004. - С. 467-468
- Potential military chemical/biological agents and compounds. - Washington: Departament of the Army, 1990. - С. 30-32
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 241-242
- Александров В.Н., Емельянов В.И. Отравляющие вещества. - 2-е изд., под ред. Сокольского Г.А. - М.: Военное издательство, 1990. - С. 121-147
- Каракчиев Н.И. Токсикология ОВ и защита от оружия массового поражения. - Ташкент: Издательство Медицина УзССР, 1973. - С. 158-160, 162-192
- Краткая химическая энциклопедия. - Т. 1: А-Е. - М.: Советская энциклопедия, 1961. - С. 1178-1179
- Общая токсикология. - Под редакцией Курляндского Б.А., Филова В.А. - М.: Медицина, 2002. - С. 242-245
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 151
- Справочник по растворимости. - Т.1, Кн.2. - М.-Л.: ИАН СССР, 1962. - С. 1321-1322
- Справочник химика. - 2 изд., Т. 2. - Л.-М.: Химия, 1964. - С. 662-663
- Химическая энциклопедия. - Т. 2. - М.: Советская энциклопедия, 1990. - С. 271
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 227
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер