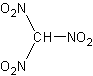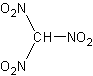Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
тринитрометан
Синонимы и иностранные названия:
trinitromethane (англ.)
нитроформ (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. моноклинные кристаллыБрутто-формула (по системе Хилла для органических веществ):
CHN3O6Формула в виде текста:
HC(NO2)3Молекулярная масса (в а.е.м.): 151,04
Температура плавления (в °C):
26,38 [Лит.]
Температура разложения (в °C):
100 [Лит.]
Растворимость (в г/100 г растворителя или характеристика):
ацетон: хорошо растворим [Лит.]
вода: 42 (20°C) [Лит.]
этанол: хорошо растворим [Лит.]
Цвет растворов:
бесцветн. (растворитель: бензол)
желт. (растворитель: вода)
бесцветн. (растворитель: диэтиловый эфир)
бесцветн. (растворитель: лигроин)
бесцветн. (растворитель: серная кислота)
бесцветн. (растворитель: сероуглерод)
желт. (растворитель: уксусная кислота)
бесцветн. (растворитель: хлороформ)
желт. (растворитель: этанол)
Плотность:
1,5967 (25°C, г/см3, состояние вещества - кристаллы)
Некоторые числовые свойства вещества:
Год открытия: 1857 (Шишков Л.Н.)
Метод получения 1:
Источник информации: Патент США US3,491,160 (от 20.01.1970)Смесь 26,1 г 97% азотной кислоты (406 ммоль), 38,8 г уксусной кислоты (646 ммоль) и 2,45 г диоксида азота (53 ммоль) были смешаны с 0,59 г ацетона (10,2 ммоль) в реакционной колбе. Температура в течение 5 часов поддерживалась от 30 до 80 С. Предполагая, что весь ацетон прореагировал и из 1 моля ацетона может быть получен 1 моль нитроформа, степень конверсии в нитроформ составляет 59%.
Способы получения:
- Действием серной кислоты на калиевую соль нитроформа. [Лит.]
Реакции вещества:
- С хлором дает тринитрохлорметан. [Лит.]
- Реагирует с формальдегидом с образованием 2,2,2-тринитроэтанола. [Лит.]
- Присоединяется к метилакрилату с образованием метилового эфира 4,4,4-тринитробутановой кислоты. [Лит.]
- Нитруется в тетранитрометан. [Лит.]
- Окисляется перманганатом калия. [Лит.]
- При действии цинка в соляной кислоте восстанавливается до гидроксиламина, аммиака, циановодорода и закиси азота. [Лит.]
- Взрывает при ударе, детонации, быстром нагревании. Насыщенный водный раствор взрывоопасен. [Лит.]
Показатель преломления (для D-линии натрия):
1,4451 (24°C)
Давление паров (в мм рт.ст.):
22 (45°C)
Дипольный момент молекулы (в дебаях):
2,7Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-32,8 (ж)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-13,4 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
435,6 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
134,1 (г)Некоторые нечисловые свойства вещества:
гигроскопичное вещество
перегоняется с водяным паром
запах резкий
Симптомы острого отравления:
Сильный метгемоглобинообразователь. Характеризуется узкой зоной острого действия. При вдыхании 0,9 мг/л из 12 белых мышей погибло 10; отмечалось раздражение слизистых дыхательных путей и глаз, затрудненное дыхание, возбуждение, судороги. При 0,3 мг/л в крови 29% метгемоглобина. При введении в желудок 300 мг/кг все животные погибли. Дистрофические изменения в печени и почках. Пороговая концентрация по влиянию на центральную нервную систему белых крыс и кошек 0,04-0,05 мг/л (Иванов, Аксюк).
Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 5-19
- Urbanski T. Chemistry and technology of explosives. - vol.1. - Warszawa, 1964. - С. 587-588
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.2. - Л.: Химия, 1976. - С. 213
- Краткая химическая энциклопедия. - Т. 3: Мальтаза-Пиролиз. - М.: Советская энциклопедия, 1964. - С. 549
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 565
- Орлова Е.Ю. Химия и технология бризантных взрывчатых веществ. - Л.: Химия, 1981. - С. 191-195
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 168
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 593
- Энергетические конденсированные системы. - Под ред. Жукова Б.П., 2-е изд. - М.: Янус-К, 2000. - С. 549-550
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер