Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
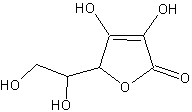
l-аскорбиновая кислота
Синонимы и иностранные названия:
2,3-дегидро-l-гулоновой кислоты γ-лактон (рус.)
L-ascorbic acid (англ.)
vitamin C (англ.)
витамин C (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. пластинчатые моноклинные кристаллыБрутто-формула (по системе Хилла для органических веществ):
C6H8O6Молекулярная масса (в а.е.м.): 176,12
Температура плавления (в °C):
191Температура разложения (в °C):
192Растворимость (в г/100 г растворителя или характеристика):
амиловый спирт: трудно растворим [Лит.]
ацетон: 0,079 (20°C) [Лит.]
ацетон: 0,097 (25°C) [Лит.]
ацетон: 0,112 (30°C) [Лит.]
ацетон: 0,13 (35°C) [Лит.]
ацетон: 0,155 (40°C) [Лит.]
ацетон: 0,176 (45°C) [Лит.]
ацетон: 0,194 (50°C) [Лит.]
ацетонитрил: 0,086 (20°C) [Лит.]
ацетонитрил: 0,103 (25°C) [Лит.]
ацетонитрил: 0,12 (30°C) [Лит.]
ацетонитрил: 0,146 (35°C) [Лит.]
ацетонитрил: 0,172 (40°C) [Лит.]
ацетонитрил: 0,193 (45°C) [Лит.]
ацетонитрил: 0,26 (50°C) [Лит.]
бензин: не растворим [Лит.]
бензол: не растворим [Лит.]
вода: 13,59 (0°C) [Лит.]
вода: 16,33 (6,99°C) [Лит.]
вода: 17,79 (10°C) [Лит.]
вода: 29,15 (20°C) [Лит.]
вода: 33,43 (25°C) [Лит.]
вода: 38,38 (30°C) [Лит.]
вода: 44,75 (35°C) [Лит.]
вода: 30,75 (40°C) [Лит.]
вода: 38,24 (50°C) [Лит.]
вода: 42,34 (60°C) [Лит.]
вода: 64,57 (70°C) [Лит.]
вода: 50,47 (80°C) [Лит.]
вода: 57,51 (100°C) [Лит.]
глицерин: 0,79 (20°C) [Лит.]
диэтиловый эфир: не растворим [Лит.]
изопропанол: 0,15 (20°C) [Лит.]
изопропанол: 0,18 (25°C) [Лит.]
изопропанол: 0,23 (30°C) [Лит.]
изопропанол: 0,29 (35°C) [Лит.]
изопропанол: 0,36 (40°C) [Лит.]
изопропанол: 0,48 (45°C) [Лит.]
изопропанол: 0,6 (50°C) [Лит.]
метанол: 5,59 (20°C) [Лит.]
метанол: 6,02 (25°C) [Лит.]
метанол: 6,76 (30°C) [Лит.]
метанол: 7,39 (35°C) [Лит.]
метанол: 8,44 (40°C) [Лит.]
метанол: 9,37 (45°C) [Лит.]
метанол: 10,26 (50°C) [Лит.]
петролейный эфир: не растворим [Лит.]
пропиленгликоль: 4,8 (25°C) [Лит.]
растительные масла: не растворим [Лит.]
тетрагидрофуран: 0,13 (20°C) [Лит.]
тетрагидрофуран: 0,164 (25°C) [Лит.]
тетрагидрофуран: 0,213 (30°C) [Лит.]
тетрагидрофуран: 0,257 (35°C) [Лит.]
тетрагидрофуран: 0,313 (40°C) [Лит.]
тетрагидрофуран: 0,374 (45°C) [Лит.]
тетрагидрофуран: 0,426 (50°C) [Лит.]
тетрахлорметан: не растворим [Лит.]
хлорбензол: не растворим [Лит.]
хлороформ: не растворим [Лит.]
этанол 96%: 3,33 (0°C) [Лит.]
этанол 96%: 4,61 (20°C) [Лит.]
этанол 96%: 5,5 (30°C) [Лит.]
этанол 96%: 6,62 (40°C) [Лит.]
этанол 96%: 8,27 (50°C) [Лит.]
этанол 96%: 10,65 (60°C) [Лит.]
этанол 96%: 17,76 (78°C) [Лит.]
этанол абсолютный: 0,88 (20°C) [Лит.]
этанол абсолютный: 2,5 (25°C) [Лит.]
этанол абсолютный: 1,05 (25°C) [Лит.]
этанол абсолютный: 1,23 (30°C) [Лит.]
этанол абсолютный: 1,48 (35°C) [Лит.]
этанол абсолютный: 1,78 (40°C) [Лит.]
этанол абсолютный: 2,06 (45°C) [Лит.]
этанол абсолютный: 2,28 (50°C) [Лит.]
этилацетат: 0,02 (20°C) [Лит.]
этилацетат: 0,026 (25°C) [Лит.]
этилацетат: 0,034 (30°C) [Лит.]
этилацетат: 0,046 (35°C) [Лит.]
этилацетат: 0,06 (40°C) [Лит.]
этилацетат: 0,076 (45°C) [Лит.]
этилацетат: 0,096 (50°C) [Лит.]
Плотность:
1,65 (25°C, г/см3, состояние вещества - кристаллы)
Вкус, запах, гигроскопичность:
вкус: кислый
запах: без запаха
Метод получения 1:
Источник информации: Меченые биологически активные вещества. Сборник статей. - М.: ГИЛОАНиТ, 1962 стр. 34-36В колбу на 250 мл, снабженную магнитной мешалкой, вносили 0,3772 г (0,007 г • моль) меченого цианистого натрия с общей активностью 20 мкюри и удельной активностью 53,02 мкюри/г, 0,613 г едкого натра (0,015 г моль) и 35 мл дистиллированной воды. К полученному раствору в течение 20 мин в токе азота постепенно добавляли 1,532 г (0,01 г • моль) раствора l-ксилозона; смесь перемешивали в токе азота в течение 10 мин. По прошествии этого времени, добавляли концентрированной соляной кислоты столько, чтобы раствор стал 2,5 N (около 22,4 мл концентрированной соляной кислоты), а затем в раствор вносили 1,532 г немеченой аскорбиновой кислоты. Колбу закрывали герметически и реакционную массу под небольшим давлением нагревали в атмосфере азота в течение 24 ч при температуре бани 50 — 51 С.
В результате реакции происходил гидролиз иминоаскорбиновой кислоты до l-аскорбиновой кислоты. После гидролиза раствор упаривали в вакууме в токе азота при 30 С. Сиропообразный остаток растворяли в 250 мл воды и отфильтровывали.
Содержание l-аскорбиновой кислоты после гидролиза определяли титрованием краской Тильманса (2,124 г). Раствор разделяли на три равные части и каждую из них пропускали со скоростью 0,5 мл/мин через колонку (1 • 60 см), содержавшую слой анионита АН-2Ф (примечание 1). l-Аскорбиновую кислоту адсорбировали на колонках, а затем элюировали 1N соляной кислотой. Конец элюирования l-аскорбиновой кислоты определяли с помощью краски Тильманса. После пропускания через анионит раствора в нем содержалось 1,623 г l-аскорбиновой кислоты. Затем раствор упаривали в вакууме в токе азота при 30 С, остаток представлял собой сиропообразную массу коричневого цвета. После титрования в ней содержалось 1593 г l-аскорбиновой кислоты. Ее растворяли в 76 мл безводного спирта и к раствору добавляли 1020 мл абсолютного, свободного от перекисей эфира. Образовавшийся в небольшом количестве хлопьевидный осадок отфильтровывали, фильтрат упаривали в колбе емкостью 500 мл в токе азота при 30 С до начала выделения кристаллов l-аскорбиновой кислоты.
После этого раствор оставляли в холодильнике на несколько дней. Выделившиеся кристаллы l-аскорбиновой кислоты отфильтровывали и промывали смесью абсолютного спирта и лигроина (1:1) до тех пор, пока фильтрат не становился бесцветным. После сушки в вакуум-эксикаторе над серной кислотой получено 574,8 мг (удельная активность 10 мкюри/г, т, е. общая активность равна примерно 6 мкюри) аскорбиновой кислоты, что составляет 41,18% по отношению к количеству l-аскорбиновой кислоты, определенной в растворе титрованием; радиохимический выход 30%, температура плавления 183 — 185 С.
Чистоту, равную 93,37%, определяли краской Тильманса. В маточнике оставалось около 60% l-аскорбиновой кислоты. Для выделения ее к маточнику добавляли несколько раз раствор немеченой l-аскорбиновой кислоты в безводном метиловом спирте, спирт отгоняли в вакууме до небольшого объема и раствор оставляли в холодильнике на ночь. На следующее утро отфильтровывали аскорбиновую кислоту. В описанном опыте немеченую аскорбиновую кислоту добавляли пять раз; получено 4,16 мкюри аскорбиновой кислоты.
Таким образом, всего из опыта получали 10,16 мкюри (6,0+ 4,16), т. е. 50% выхода.
Примечание 1. Для приготовления колонки из смолы марки АН-2Ф смолу заливали на день-два дистиллированной водой и многократно декантировали. После этого смолу промывали таким же способом 10%-ным раствором уксусной кислоты и, наконец, водой до нейтральной реакции. Затем через колонку пропускали растворы немеченой аскорбиновой кислоты и 200 мл раствора водного аммиака (2 N), Анионит отмывали водой до нейтральной реакция, а затем 350 мл 10%-ного раствора уксусной кислоты. Таким образом, анионит был приготовлен в ацетатной форме.
Способы получения:
- Была синтезирована из L-ксилозона, действием цианида калия, хлорида кальция и затем соляной кислоты. [Лит.]
- Синтезируется 8-стадийным синтезом из глюкозы. [Лит.]
Реакции вещества:
- При кипячении с соляной кислотой образует фурфурол. (выход 100%) [Лит.]
- Реагирует с трифенилхлорметаном в пиридине с образованием 6-O-трифенилметильного производного. [Лит.]
- С диазометаном дает 2,3-ди-O-метильное производное. [Лит.]
- Реагирует с акролеином в кислой среде давая 5,6-O-ацеталь. [Лит.]
- Реагирует с бензальдегидом в кислой среде давая 5,6-O-ацеталь. [Лит.]
- Реагирует с ацетоном в кислой среде давая 5,6-O-изопропилиденкеталь. [Лит.]
- Окисляется иодом до дегидроаскорбиновой кислоты. [Лит.]
- Реагирует со слабощелочным раствором хлорида железа(III) с появлением синей окраски. В кислой среде окраска возникает вспышками из-за восстановления железа(III) до железа(II). [Лит.]
- В присутствии солей меди(II) восстанавливает кобальт(III) в витамине B12 до кобальта(II). [Лит.]
- Окисляется на воздухе в присутствии ионов меди(II) до дегидроаскорбиновой кислоты, 2,3-дикетогулоновой кислоты и других продуктов. [Лит.]
- Реагирует со смесью бромата и иодида давая маятниковую реакцию. Ионы металлов ускоряют эту реакцию. [Лит.]
Стандартный электродный потенциал:
дегидроаскорбиновая кислота + 2H+ + 2e- → аскорбиновая кислота, E = -0,058 (вода, 25°C)
Показатели диссоциации:
pKa (1) = 4,1 (24°C, вода, 3-C-OH)
pKa (2) = 11,79 (16°C, вода, 2-C-OH)
Удельное вращение для D-линии натрия:
+23 (вода, 1,6 г/100 г, 20°C)
+48 (метанол, 20°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль)
-1164,6 (т) [Лит.]
Некоторые нечисловые свойства вещества:
водный раствор имеет кислую реакцию среды (рН 2 при концентрации 50 мг/мл)
Летальная доза (ЛД50, в мг/кг):
3367 (мыши, перорально)
518 (мыши, внутривенно)
643 (мыши, внутрибрюшинно)
Природные и антропогенные источники:
Содержится практически во всех растениях. Содержание (мг/кг): земляника садовая (плоды) = 600, крыжовник (плоды) = 300, малина (плоды) = 250, смородина (плоды) = 2000, шиповник (плоды) = 6500, картофель (клубни) = 70, морковь (корнеплод) = 100, свекла (корнеплод) = 100, груша (плоды) = 80, яблоки (плоды) = 20, актинидия коломикта = 8200-11700.
Фармакологическое взаимодействие:
Аскорбиновая кислота повышает концентрацию в крови салицилатов (возрастает риск кристаллурии), бензилпеницилллина, тетрациклина. Снижает концентрацию в крови пероральных антикоагулянтов. Улучшает всасывание в кишечнике препаратов железа. Увеличивает выведение этилового спирта.
Побочное действие:
Может вызывать раздражение слизистой желудочно-кишечного тракта, нарушать функцию инсулярного аппарата поджелудочной железы, вызывать гипертроминемию, способствовать развитию гипергликемии и глюкозурии, тромбоцитоза.
При лечении большими дозами необходимо следить за функцией почек и артериальным давлением (в связи со стимулирующим влиянием на образование кортикостероидных гормонов) и за функцией поджелудочной железы (из-за угнетения ее инсулярного аппарата).
Анализ вещества:
Восстанавливает нитрат серебра до металлического серебра. Обесцвечивает 2,6-дихлорфенолиндофенол. Количественно определяют иодиметрически. УФ-спектр: максимум при 245 нм (рН менее 7) и 265 нм (рН более 7).
При добавлении к 5 мл водного раствора аскорбиновой кислоты (1:1000) по каплям 0,1 н раствора иода, происходит обесцвечивание окраски иода.
К раствору 50 мг аскорбиновой кислоты в 2 мл воды прибавляют 0,1 г гидрокарбоната натрия и около 20 мг сульфата железа (II), встряхивают и оставляют стоять. Появляется темно-фиолетовое окрашивание аскорбината железа (II) (HOCH2CH(OH)C4HO4)2Fe, исчезающее при добавлении 5 мл разведенной серной кислоты.
Применение:
Лекарственный препарат группы витаминов. Специфическое лекарственное средство при цинге.
История:
Изолирована впервые Цильва (1918-1925) из лимонов и названа фактором восстановления. Повторно была изолировна Агопианом (1920-1925) и наконец Сцент-Дьердьи (1928), который нашел ее в надпочечниках,капусте, красном перце и дал ей название "гексуроновая кислота". Строение витамина было установлено благодаря работам Хирста (1933), Михеля и Крафта (1933). Первые ее синтезы опубликованы Рейхштейном (1933) и Хавортом (1933).
Дополнительная информация::
Устойчива в сухом виде в темноте. Является восстановителем. Водные растворы легко окисляются на воздухе до дегидроаскорбиновой кислоты, особенно в присутствии щелочей и следов меди или железа. Окислителями сначала окисляется обратимо до дегидроаскорбиновой кислоты, затем необратимо до 2,3-дикетогулоновой, а затем до щавелевой кислоты.
С растворами щелочей образует соли, с хлорангидридами высших жирных кислот - сложные эфиры, с катионами металлов (кальций, магний, железо (III)) - комплексы.
Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 3-28
- CRC Handbook of Chemistry and Physics. - 95ed. - CRC Press, 2014. - С. 3-30
- Clarke's isolation and identification of drugs. - 2ed. - London: Pharmaceutical press, 1986. - С. 360-361
- Journal of Chemical and Engineering Data. - 2010. - Vol. 55, No. 4. - С. 1718-1721 (растворимость) [DOI: 10.1021/je900687y]
- Kleemann A. Pharmaceutical Substances. - 2000. - С. 137-138
- Lewis R.J. Sax's Dangerous Properties of Industrial Materials. - 11ed. - Wiley-interscience, 2004. - С. 309-310
- Stahl P.H., Wermuth C.G. Handbook of Pharmaceutical Salts: Properties, Selection, and Use. - Wiley-VCH, 2002. - С. 271-272
- The Merck Index 11th ed., Merck & Company, 1989. - С. 130-131
- The Merck Index. - 15th ed. - Royal Society of Chemistry, 2013. - С. 142-143
- Yalkowsky S.H., Yan H. Handbook of aqueous solubility data. - CRC Press, 2003. - С. 277
- Березовский В.М. Химия витаминов. - М.: Пищевая промышленность, 1973. - С. 19-56
- Девис М., Остин дж., Патридж Д. Витамин С: химия и биохимия. - М.: Мир, 1999
- Машковский М.Д. Лекарственные средства. - 15-е изд. - М.: Новая волна, 2007. - С. 627-628
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 125
- Руководство к лабораторным занятиям по фармацевтической химии. - Под ред. Арзамасцева А.П. - М.: Медицина, 1987. - С. 147
- Скурихин И.М., Нечаев А.П. Все о пище с точки зрения химика. - М.: Высшая школа, 1991. - С. 244
- Фруентов Н.К. Лекарственные растения Дальнего Востока. - Хабаровск: Хабаровское книжное издательство, 1987. - С. 8
- Халецкий А.М. Фармацевтическая химия. - Л.: Медицина, 1966. - С. 634-638
- Химическая энциклопедия. - Т. 1. - М.: Советская энциклопедия, 1988. - С. 384-385
- Шнайдман Л.О. Производство витаминов. - М., 1973. - С. 236-296
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер