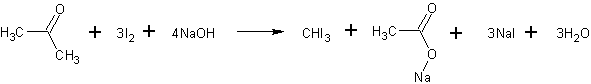Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
трииодметан
Синонимы и иностранные названия:
iodoform (англ.)
triiodomethane (англ.)
иодоформ (рус.)
йодоформ (рус.)
Тип вещества:
органическое
Внешний вид:
желт. гексагональные кристаллы (растворитель перекристаллизации - ацетон)Брутто-формула (по системе Хилла для органических веществ):
CHI3Формула в виде текста:
CHI3Молекулярная масса (в а.е.м.): 393,72
CAS №: 75-47-8
Температура плавления (в °C):
123Температура возгонки (сублимации) (в °C):
210Растворимость (в г/100 г растворителя или характеристика):
1,1,2-трифтор-1,2,2-трихлорэтан: мало растворим [Лит.]
ацетон: растворим [Лит.]
бензол: не растворим [Лит.]
вода: 0,01181 (25°C) [Лит.]
глицерин 95%: 0,123 (15°C) [Лит.]
диметилсульфоксид: мало растворим [Лит.]
диэтиловый эфир: 13,6 (25°C) [Лит.]
жирные масла: мало растворим [Лит.]
иод жидкий: растворим [Лит.]
сероуглерод: растворим [Лит.]
уксусная кислота: растворим [Лит.]
хлороформ: растворим [Лит.]
этанол: 1,3 (18°C) [Лит.]
этанол: 7,8 (78°C) [Лит.]
Плотность:
4,008 (20°C, относительно воды при 4°C, состояние вещества - кристаллы)
Метод получения 1:
Источник информации: Гитис С.С., Глаз А.И., Иванов А.В. Практикум по органической химии: Органический синтез. - М.: Высшая школа, 1991 стр. 147-148
В стакан помещают 4 г иодида калия, приливают 7,5 мл дистиллированной воды и после растворения соли добавляют 2 г иода. К полученному раствору приливают 17,5 мл воды. Затем в реакционную массу вводят 5 мл ацетона и при перемешивании по каплям добавляют из капельной воронки 10%-ный раствор гидроксида натрия до исчезновения красноватой окраски раствора (приблизительно 4,5 мл). Йодоформ, который при этом выпадает в виде желтого кристаллического осадка, через 30 мин отфильтровывают на воронке Бюхнера, промывают небольшим количеством воды и высушивают на воздухе.
Выход 0,93 г (90% от теоретического).
Йодоформ (трииодметан) — твердое кристаллическое вещество желтого цвета со специфическим запахом и т. пл. 119°С. Растворяется в этиловом спирте, диэтиловом эфире, хлороформе. В воде практически нерастворим, не перегоняется с водяным паром. Под действием света быстро гидролизуется раствором щелочи, поэтому следует избегать сильнощелочной среды в процессе синтеза.
Способы получения:
- Электрохимическое окисление этанола с раствором иодида калия. (выход 85%) [Лит.]
Используется для синтеза веществ:
дииодметан
Реакции вещества:
- С хлоридом изопропилмагния при -78 С в тетрагидрофуране дает желтый раствор, содержащий 2-иодпропан и хлорид дииодметилмагния, который разлагается кислотами до дииодметана. При избытке иодоформа образуется красный раствор комплекса с мостиковым иодом (I2CH-I-CHI2)MgCl. [Лит.]
- Реагирует с магнием с образованием ацетилена. [Лит.]
Давление паров (в мм рт.ст.):
0,0075 (51,1°C)
0,075 (82,7°C)
0,75 (121°C)
750 (218°C)
Дипольный момент молекулы (в дебаях):
1 (20°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль)
-181,1 (т) [Лит.]
251 (г) [Лит.]
Стандартная энтропия S (298 К, Дж/(моль·K))
356,2 (г) [Лит.]
Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K))
75 (г) [Лит.]
Энтальпия плавления ΔHпл (кДж/моль)
16,44 (т) [Лит.]
Некоторые нечисловые свойства вещества:
перегоняется с водяным паром
Природные и антропогенные источники:
Продуцируется Aspergillus taxiformis.
Симптомы острого отравления:
Животные. При введении крысам 2600 ммоль меченого трииодметана на 100 г массы тела обнаруживаются нарушения ферментных систем печени с последующим развитием центродолевого некроза, сходного с вызываемым тетрахлорметаном. Для крыс при однократном 7-часовом ингаляционном воздействии и 24-часовом наблюдении ЛК50=183 млн-1. В другом опыте крыс ингалировали трииодметаном в концентрациях 1 или 14 млн-1 по 7 ч в день в течение 7 дней. При обеих концентрациях трииодметана не отмечали отличий от контроля в потреблении корма и воды, выделении мочи и фекалий, в гематологических показателях. Гистологически выявили минерализованные отложения в канальцах мозгового вещества почек у некоторых крыс при большей концентрации трииодметана. Установлена мутагенная активность трииодметана по тесту Эймса в зависимости от уровня воздействия (Nakashima et al.).
Человек. Имеются указания об ототоксическом действии трииодметана. Известны случаи экземы. Порог рефлекторного действия (по изменению биоэлектрической активности коры головного мозга) — 0,13 мг/м3.
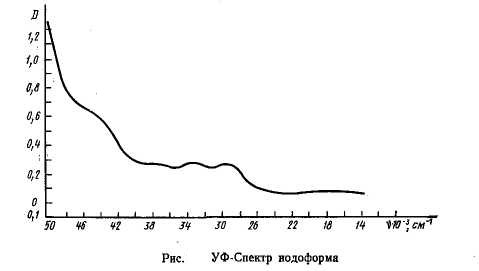
Графические спектры вещества:
Ультрафиолетовый/видимый спектр
Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 5-19
- CRC Handbook of Chemistry and Physics. - 95ed. - CRC Press, 2014. - С. 3-530
- Dictionary of Inorganic Compounds. - Vol. 1: Ac-C10, part 1. - Springer Science+Business Media Dordrecht, 1992. - С. 415
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 21-22
- Yalkowsky S.H., Yan H. Handbook of aqueous solubility data. - CRC Press, 2003. - С. 5
- Беликов В.Г. Учебное пособие по фармацевтической химии. - М.: Медицина, 1979. - С. 95
- Краткая химическая энциклопедия. - Т. 2: Ж-Малоновый эфир. - М.: Советская энциклопедия, 1963. - С. 292-293
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 553
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 151
- Справочник по растворимости. - Т.1, Кн.2. - М.-Л.: ИАН СССР, 1962. - С. 1106-1107
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер